Адсорбция на границе жидкость – газ
Адсорбция-это изменение концентрации компонента в поверхностном слое по сравнению с объемной фазой, отнесенное к единице площади поверхности (моль/м2). Молекулы ПАВ в воде после перемешивания распределены равномерно. Затем вследствие меньшей полярности молекул ПАВ они самопроизвольно переходят в поверхностный слой до тех пор, не скомпенсируются встречным процессом диффузии.
Вполне возможна и ситуация, когда площадь межфазной поверхности не имеет возможности изменяться. Тогда должен меняться коэффициент поверхностного натяжения. И если для жидкости моносостава (дистиллированная вода) это невозможно в принципе, то в растворах, состоящих из нескольких жидкостей с разным коэффициентом поверхностного натяжения, этот процесс осуществляется легко - путем изменения концентрации одного из компонентов в поверхностном слое по сравнению с его концентрацией во всем остальном объеме. Этот эффект называется адсорбцией.
В зависимости от природы адсорбционных сил она может быть физической и химической (хемсорбция). Физическая адсорбция обратима, а химическая - нет.
Как видим, подобные процессы возможны только в смесях из двух и более жидкостей с разным поверхностным натяжением - в растворах.
Описанное нами явление проявляется еще и в том, что один их компонентов раствора, даже если его количество ничтожно мало по отношению к другому компоненту, концентрируется на поверхности и тем самым изменяет поверхностное натяжение.
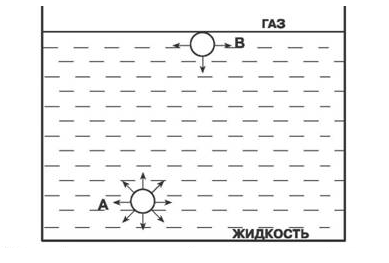 Рис 1. Силы действующие на молекулу А уравновешены ,силы действуюшие на молекулу В, не уравнвешены
Рис 1. Силы действующие на молекулу А уравновешены ,силы действуюшие на молекулу В, не уравнвешены
|
Вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ). Они взаимодействуют с водой слабее, чем молекулы воды между собой, значит, попадая на поверхность, они уменьшают поверхностное натяжение. К ним относятся спирты, жирные, нефтяные, нафтеновые и смоляные кислоты и их соли, амины и множество других веществ, имеющих дефильное строение, - то есть полярную часть (функциональные группы) и неполярную (углеводородный радикал).
Вещества, понижающие поверхностное натяжение, называются поверх - ностно-инактивными (ПИВ). К ним относятся сильные электролиты: соли, щелочи, кислоты. Все эти соединения в воде диссоциируются на ионы, которые взаимодействуют с молекулами воды сильнее, чем сами эти молекулы между
собой. Поэтому значительная часть ионов увлекается молекулами воды в объем раствора. Однако немногие оставшиеся на поверхности ионы создают вблизи поверхности силовое поле, тем самым, повышая поверхностное натяжение.
Вещества, которые не способны растворяться в воде, либо растворение которых практически не приводит к изменению поверхностного натяжения, называются поверхностно неактивными веществами (ПНВ) (см. рис. 2)
Анализ графика показывает, что увеличение поверхностного натяжения под влиянием ПИВ сначала происходит незначительно; это связано с тем, что концентрация ионов в поверхностном слое также незначительна, и по составу он близок к чистому растворителю. А вот для ПАВ характерно резкое снижение поверхностного натяжения даже в очень малых концентрациях, что обусловлено концентрацией молекул ПАВ в приповерхностном слое благодаря адсорбционным процессам. По мере роста концентрации ПАВ снижение поверхностной активности уменьшается и на определенном этапе стабилизируется.
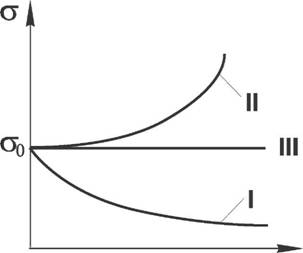 Рис. 2 Зависимость поверхностного натяжения от концентрации растворенного вещества (С) для:
I - поверхностно активных веществ (ПАВ);
II - поверхностно неактивных веществ (ПНВ);
III - поверхностно инактивных веществ (ПИВ);
Ст0 - коэффициент поверхностного натяжения растворителя (воды).
Рис. 2 Зависимость поверхностного натяжения от концентрации растворенного вещества (С) для:
I - поверхностно активных веществ (ПАВ);
II - поверхностно неактивных веществ (ПНВ);
III - поверхностно инактивных веществ (ПИВ);
Ст0 - коэффициент поверхностного натяжения растворителя (воды).
|
Молекулы ПАВ, адсорбируясь на поверхности раздела жидкости с воздухом, образуют своеобразный поверхностный слой, в котором они располагаются строго определенным образом.
Ориентация молекул ПАВ происходит так, что гидрофильная часть молекулы (головка) находится в водной фазе, а гидрофобная часть (хвостик) стремится наружу.
Лишь при очень небольшой концентрации ПАВ в растворе молекулы могут располагаться относительно произвольно. По мере повышения концентрации ПАВ их расположение в поверхностном слое все более упорядочивается. В практически применяемых растворах содержание ПАВ обычно такое, что его молекулы образуют на поверхности раздела плотный слой из молекул, ориентированных перпендикулярно поверхностному слою.
Благодаря явлению адсорбции концентрация молекул ПАВ в поверхностном слое даже для сильно разбавленных растворов в миллионы раз превышает их концентрацию во всем остальном объеме раствора.
По достижению определенной концентрации, отдельные молекулы ПАВ в растворе начинают объединяться в агрегаты – мицеллы..
Благодаря явлению адсорбции концентрация молекул ПАВ в поверхностном слое даже для сильно разбавленных растворов в миллионы раз превышает их концентрацию во всем остальном объеме раствора.
По достижению определенной концентрации, отдельные молекулы ПАВ в растворе начинают объединяться в агрегаты - мицеллы.
Величина такой концентрации, когда количественные критерии переходят в качественные, называется критической концентрацией мицеллообразова - ния - ККМ. В области ККМ происходит резкое изменение свойств растворов ПАВ - поверхностного натяжения, электропроводности, плотности и др. На величину ККМ значительным образом оказывает влияние вид и количество растворенных в воде примесей, и в первую очередь водорастворимых солей.
Дата добавления: 2016-11-26; просмотров: 4164;











