Уравнение адсорбции Гиббса
Вернемся к рассмотрению процессов, идущих на поверхности ж/г, поскольку эта поверхность, безусловно, энергетически однородна.
При растворении в воде ПАВ накапливаются в поверхностном слое, ПИВ — в растворе. Распределение вещества между поверхностным слоем и объемом среды подчиняется принципу минимальной энергии: на поверхности осаждается то вещество, которое обеспечивает наименьшее поверхностное натяжение: в первом случае ПАВ, во втором вода.
Рассмотрим процессы адсорбции этих веществ на границе раздела фаз. Вспомним влияние концентрации растворенных веществ на границе раздела фаз на поверхностное натяжение.
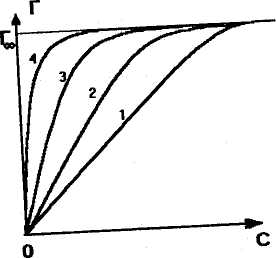
Когда концентрация адсорбата (СПАВ) на поверхности больше, чем в объеме среды, то наблюдается уменьшение поверхностного натяжения вследствие образования на границе раздела фаз ориентированного слоя, т.е. адсорбированного слоя. В этом случае Г > 0, при этом величина  поверхностной активности
поверхностной активности 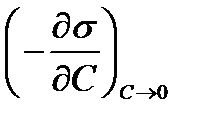 > 0. Это отражено на рис.2.18 кривой 1. Г∞ — величина предельной адсорбции при образовании монослоя.
> 0. Это отражено на рис.2.18 кривой 1. Г∞ — величина предельной адсорбции при образовании монослоя.
При недостатке вещества в поверхностном слое Г < 0. Это можно наблюдать при изучении адсорбции ПИВ.
Кривая 2, описывающая адсорбцию ПИВ в поверхностном слое, (отрицательная адсорбция ПИВ) говорит о вытеснении молекул растворенного вещества с поверхности в глубь фазы.
Г
С
Рис 2.18. Изотермы адсорбции ПАВ (1) и ПИВ (2)
Процесс насыщения монослоя тормозится тепловым движением, которое увлекает часть молекул внутрь фазы. С уменьшением Т тепловое движение ослабевает, и избыточная адсорбция Г при той ж концентрации увеличивается (рис.2.19).
Г Т3> Т2 >Т1
1 2 3
С
Рис. 2.19. Изотермы адсорбции ПАВ при разных температурах
Простых и доступных методов определения избыточной адсорбции Г не существует. Однако на поверхности ж/г легко измерить поверхностное натяжение, а затем использовать очевидную связь между поверхностным натяжением и адсорбцией для расчета избыточной адсорбции ГПАВ.
(Вывод уравнения Гиббса. Обычно не даю)
Запишем для единицы площади при постоянной температуре:
 , (2.51)
, (2.51)
где μ — химический потенциал, равный 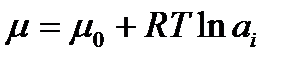 . (2.52)
. (2.52)
μо — абсолютный химический потенциал данного компонента, R — универсальная газовая постоянная, Т — температура, a — активность компонента в растворе.
Произведем дифференцирование этого уравнения:
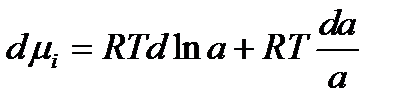 (2.53)
(2.53)
Отсюда: 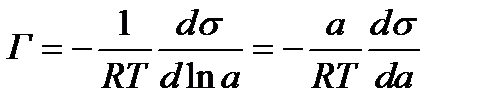 (2.54)
(2.54)
При малых концентрациях а можно заменить на с изаписать
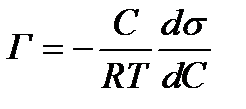 . (2.55)
. (2.55)
Уравнение (2.55) Гиббса позволяет рассчитать избыточную адсорбцию Г — разность между концентрацией адсорбтива в поверхностном слое и объемом раствора для концентрации С раствора ПАВ.
Уравнение Гиббса с точки зрения термодинамики универсально и применимо к границам раздела любых фаз.
Уравнение Гиббсабыло многократно подтверждено экспериментально, в частности, методом среза тонких слоев жидкости (с помощью специального ножа - микротома) с последующим анализом их состава, а также - исследованием распределения метки радиоактивного изотопа между поверхностью жидкости и её объёмом.
Измерение адсорбции на твердых адсорбентах обычно производят по убыли концентрации адсорбата в растворе (до и после адсорбции). Поверхность адсорбента, как правило, не велика ΔС составляет лишь несколько процентов от значения самой концентрации. Поэтому для получения достоверных опытных данныx необходимо измерять концентрации с очень большой точностью. В отличие от этого, исследования адсорбции на поверхности жидкость - газ крайне просты. Они сводятся к получению зависимости поверхностного натяжения от концентрации адсорбата, графическому дифференцированию кривой А = f(C) и расчету Г.
Область практического использования уравнения Гиббса для определения величины адсорбции ограничена системами, у которых доступно экспериментальное определение поверхностного натяжения, т.е. системами ж/г и ж/ж.
(Здесь следует показать на графиках, как из зависимости σ = f(C) перейти к Г = f(C)).
σ Г
с1 с1 С
Рис. 2.20. Расчет и построение изотермы адсорбции, исходя из изотермы поверхностного натяжения
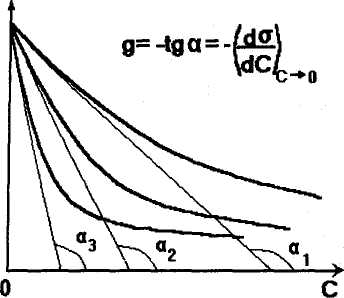
Правило Дюкло — Траубе:
Это правило работает в растворах гомологических рядов ПАВ и формулируется следующим образом:
С увеличением длины углеводородного радикала на одну группу СН2, поверхностная активность растет в гомологическом ряду в 3 — 3,5 раза.
Проиллюстрируем это правило графически:
σ
а б
Рис.2.21. Изотермы поверхностного натяжения(а) и адсорбции (б) растворов ПАВ одного гомологического ряда (1,2,3 - число групп -СН2- в углеводородном радикале)
Обратим внимание на то, что значение Г∞ для одного гомологического ряда остается постоянным. Это объясняется тем, что емкость монослоя в этом случае зависит только от площади, которую занимает молекула ПАВ в этом слое. В рядах карбоновых кислот, спиртов эта площадь определяется величиной полярной группы, одинаковой для всего ряда ПАВ.
Это правило соблюдается для истинно растворимых ПАВ. Т.к. поверхностная активность определяется для бесконечно разбавленных систем, то легко объяснить ее зависимость от длины углеводородного радикала. Чем длиннее радикал, тем сильнее выталкивается молекула ПАВ из водного раствора, т.к. встраивание радикала в воду увеличивает ΔG, и процесс выхода молекул на поверхность энергетически очень выгоден.
Уравнение Шишковского(*)
Для случая адсорбции молекул ПАВ на границе раздела фаз можно использовать оба предложенных уравнения адсорбции на однородной поверхности. Приравняем их друг другу:
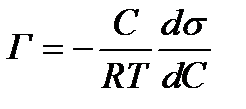 =
= 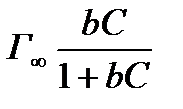 (2.56)
(2.56)
Разделим переменные и проинтегрируем эти уравнения:

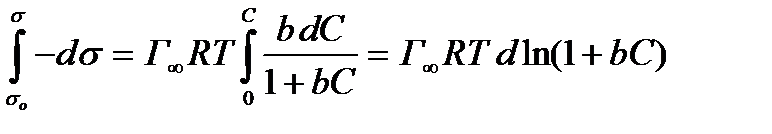 , (2.57)
, (2.57)
отсюда

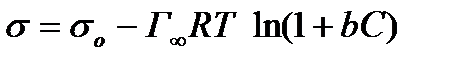 , (2.58)
, (2.58)
Так как в растворах ПАВ вследствие их высокой поверхностной активности значения абсолютной адсорбции А практически равны избыточной адсорбции Г, поэтому выведенное уравнение может быть записано и в виде: 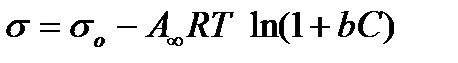 . (2.59)
. (2.59)
Полученное уравнение носит название уравнения Шишковского. Первоначально оно было выведено им эмпирически для описания зависимости поверхностного натяжения от концентрации ПАВ:
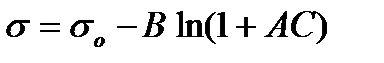 , (2.60)
, (2.60)
В уравнение (2.60) входят коэффициенты В и А, физический смысл которых виден из выше выведенного уравнения (2.59).
Связь между поверхностным натяжением и адсорбцией можно проследить в уравнении Фрумкина(*):
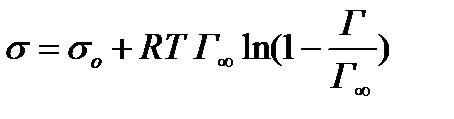 , (2.61)
, (2.61)
из которого следует, что при одинаковой адсорбции все гомологи уменьшают поверхностное натяжение на одну и ту же величину ∆σ.
Различие поверхностной активности в гомологическом ряду ПАВ обусловлено различной особенностью их к адсорбции, т.е. одно и то же значение Г достигается для короткоцепочечных ПАВ при значительно больших С, чем для длинноцепочечных ПАВ. Но если концентрации у гомологов таковы, что их адсорбции одинаковы, то они понижают σна одну и ту же величину.
Дата добавления: 2016-07-27; просмотров: 3887;











