Изотермы адсорбции на неоднородной поверхности
Представления о неоднородной поверхности было впервые выдвинуты в работах Теллера(*), Брунауэра(*) и развиты Фрумкиным(*), Тёмкиным(*) и др. учеными.
Было показано, что теплота адсорбции не постоянна и почти всегда уменьшается с увеличением степени заполнения поверхности.
Если бы все центры адсорбции поверхности были энергетически эквивалентны (поверхность однородна), то дифференциально-молярная теплота адсорбции q по мере заполнения поверхности q не изменялась бы (линия 1 на рис.2.22).
Снижение теплоты адсорбции по мере увеличения степени заполнения поверхности объясняют двумя причинами:
а) биографическая неоднородность — первоначальная неоднородность: выход на поверхность различных кисталлографических граней, ребер, узлов, мест включения примесей и т.д.
б) индуцированная неоднородность связана с самим процессом адсорбции из-за электростатического взаимодействия адсорбированных частиц, вызванного появлением одноименных зарядов; изменением электронной структуры адсорбента вследствие изменения концентрации свободных электронов или протонов на поверхности и смещения уровня Ферми.
По мере заполнения поверхности усиливается взаимное отталкивание адсорбированных частиц (т.н. латеральные взаимодействия), в результате чего каждой новой частице приходится затрачивать на адсорбцию больше энергии, чем предыдущим, и поэтому энергия, выделяющаяся в форме теплоты, уменьшается.
Таким образом, как неоднородность поверхности, так и взаимодействие адсорбированных частиц приводит к зависимости qадс от степени заполнения поверхности адсорбента (рис.2.22).
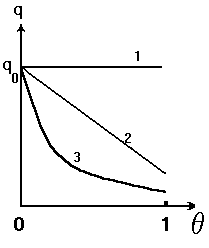
Рис.2.22. Зависимость дифференциальной теплоты адсорбции q от степени заполнения поверхности q.
.
1 - Прямая 1отвечает условию теории Ленгмюра о независимости теплоты адсорбции от степени заполнения поверхности.
2 – В первую очередь адсорбция идет на центрах более ненасыщенных ("жадно" адсорбирующих) с выделением максимальной теплоты qo. Далее заполняются центры, слабее адсорбирующие, и выделяющаяся теплота по мере их покрытия снижается. Линейная зависимость qst от q (линия 2) означает, что центров всех сортов на поверхности примерно одинаково.
q=f(Θ); q= qо – k Θ (2.66)

Для равномерно неоднородной поверхности (примерно одинаковое число всех центров адсорбции) уравнение изотермы, полученное М.И. Тёмкиным, имеет вид:
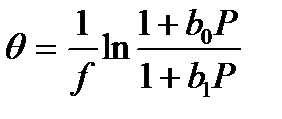 , (2.67)
, (2.67)
где f - показатель неоднородности, равный ln(b0/b1). При больших значениях Р, когда b0×P >> 1 и b1×P >> 1, пренебрегая 1 по сравнению с b0×P и b1×P, получаем 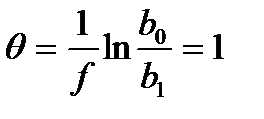 , (2.68)
, (2.68)
т.е. имеет место насыщение поверхности.
Напротив, при малых Р, когда b0×P << 1 и b1×P << 1, разлагая ln(1+b0P) и ln(1+b1P) в ряд и ограничиваясь первым членом ряда, получаем 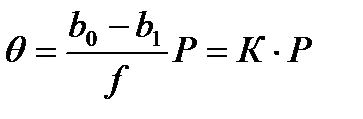 , (2.69)
, (2.69)
т.е. приходим к линейной изотерме Генри.
Для средних заполнений поверхности уравнение трансформируется в:
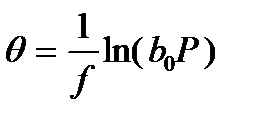 или
или 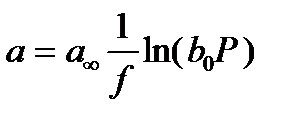 , (2.70)
, (2.70)
Эти изотермы адсорбции в литературе называют логарифмической изотермой или изотермой Тёмкина.
3. – Кривая 3 на рис.2.22 соответствует тому случаю, когда сильно адсорбирующих центров на поверхности мало, а большинство центров адсорбируeт слабо (с выделением малой теплоты). Адсорбция на экспоненциально неоднородной поверхности, описывается эмпирическим уравнением, впервые предложенным Фрейндлихом(*) (изотерма Фрейндлиха):
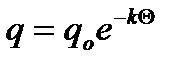 , (2.71)
, (2.71)
в котором k=f(T, природы адсорбента и адсорбата).
Как показал Зельдович(31) в области средних заполнений
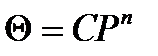 , где С и n — константы, 0<n<1. (2.72)
, где С и n — константы, 0<n<1. (2.72)
Чаще всего это уравнение используют в логарифмической линейной форме:
lnA=lnk + n lnP, (2.73)
k — адсорбционный показатель, зависит от природы адсорбента и Т; с увеличением Т уменьшается, а n растет.
Следует иметь в виду, что изотерма вида (2.71) не может описать всю реальную изотерму адсорбции. Действительно, при полном покрытии всех центров адсорбции а = а¥, т.е. в области больших Р обычно наблюдают независимость адсорбции от давления, а рассматриваемое уравнение предсказывает бесконечное увеличение а с ростом давления.И наоборот, при малых Р эксперименты дают линейную связь а и Р (изотерма Генри). Уравнение же лишь с определённой погрешностью может быть аппроксимировано в линейную зависимость. По этой причине сложилось мнение, что изотерма Фрейндлиха справедлива лишь в интервале средних концентраций адсорбата.
2.4.3. Теории полимолекулярной адсорбции
а) теория Поляни(*)
Возможность образования полимолекулярных слоев в пористых адсорбентах рассматривается в потенциальной теории Поляни.
Эта теория была предложена для термодинамического описания полимолекулярной адсорбции. Она устанавливает связь величины адсорбции с давлением адсорбата и дифференциальной теплотой адсорбции. Наиболее удачно она предсказывает зависимость величины адсорбции как функции температуры.
Теория не приводит к конкретным уравнениям, но широко используется для описания адсорбции на пористых адсорбентах, т.к. часто эта зависимость А=f(Р) имеет вид:
А
1 Р/Ро
Рис. 2.23. Изотерма полимолекулярной адсорбции
Основные положения теории Поляни:
1. Адсорбция обусловлена чисто физическими силами взаимодействия.
В адсорбционном пространстве действуют только дисперсионные силы, не зависящие от температуры. На поверхности адсорбента нет активных центров, а адсорбционные силы образуют около поверхности адсорбента непрерывное силовое поле. Адсорбционные силы действуют на расстоянии, большем, чем диаметр отдельной молекулы.
При адсорбции характер взаимодействия между молекулами адсорбата не изменяется, а происходит увеличение его плотности на поверхности адсорбента. Силы по мере удаления от поверхности на некотором расстоянии от нее становятся равными 0.
2. Всё адсорбированное вещество на поверхности находится в жидком состоянии. Объём, занимаемый адсорбатом, равен
Vж.адс.=АVм . (2.74)
3. За меру интенсивности адсорбционного взаимодействия принят адсорбционный потенциал, работа переноса 1 моль газа с поверхности жидкого адсорбата (ро) в равновесную газовую фазу (р):
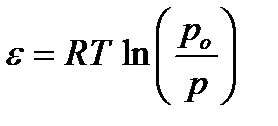 , (2.75)
, (2.75)
он характеризует работу против внешних вил.
С приближением к поверхности адсорбента адсорбционные возрастают, а потом уменьшаются, доходя до 0 и переходя в силы отталкивания. Таким образом создаётся адсорбционное поле, каждой точке которого соответствует определенное значение адсорбционного потенциала ε.
Молекулы газа, попадая в адсорбционное поле, притягиваются поверхностью адсорбента. Образуется полимолекулярный слой, плотность которого уменьшается по мере удаления от поверхности.
Адсорбционный слой напоминает атмосферу: вблизи поверхности твердого тела он сжат, а в наружных слоях — разрежен. Представление о потенциальном поле дают эквипотенциальные поверхности

поверхности одинакового потенциала
Расстояние между каждой парой эквипотенциальных поверхностей соответствует некоторому объёму, поэтому между потенциалом ε и V существует определенная зависимость.
В адсорбционном пространстве действуют дисперсионные силы, которые не зависят от температуры. Каждой точке изотермы адсорбции соответствуют определенные значения А и Р/Ро, которая позволяет получать значения ε и V, зависимость ε=f(Т) и заменить зависимость ε=f(r) на ε=f(Vж.адс.). Зависимость ε=f(r) называется потенциальной кривой адсорбции. Ее можно построить, исходя из экспериментально полученной изотермы адсорбции, зная распределение Vж.адс по адсорбционному пространству:
ε
V
Рис. 2.24. Потенциальная кривая адсорбции
Пользуясь этой зависимостью, можно построить изотерму при любой температуре, получив изотерму адсорбции при одной температуре Т1.
Так как дисперсионные силы не зависят от температуры, то от температуры не должна зависеть и форма потенциальной кривой адсорбции, что подтверждается и экспериментально. Экспериментальные точки при разных температурах ложатся на одну и ту же зависимость ε=f(Vж.адс.), которую называют характеристической кривой: 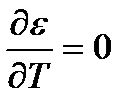 . (2.76)
. (2.76)
Для двух температур: V=А1VМ1 = А2VМ2 (2.77)
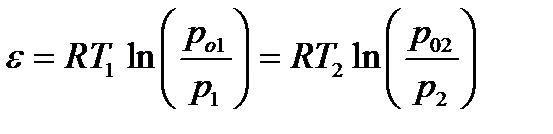 (2.78)
(2.78)
а lnP
Т1 α α=-qst / R
Т2
Р 1/T
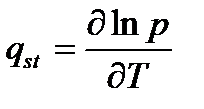 , исходя из уравнения Клаузиуса—Клапейрона(33,34)
, исходя из уравнения Клаузиуса—Клапейрона(33,34) 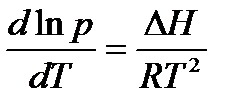 (2.79)
(2.79)
Рис.2.25. Построение и расчент изотерм адсорбции из одной изотермы по теории Поляни
Важное свойство было обнаружено Дубининым(*):
Характеристические кривые для одного и того же адсорбента и разных адсорбатов при всех значениях объёма адсорбата в поверхностном слое находятся в постоянном соотношении: β=(ε/ εо)V, где β — коэффициент аффинности.
Отсюда следует, что, зная характеристическую кривую для одного адсорбата и β для другого по отношению к первому, можно вычислить изотерму адсорбции для 2-го адсорбата на том же адсорбенте.
Теория Поляни не дала математического выражения для изотермы адсорбции, однако ее представления положены в основу и используются современной теорией объёмного заполнения пор молекулами адсорбата. Она не потеряла практического значения и остается теорией, пригодной для описания адсорбции на адсорбентах с резкой энергетической неоднородностью (на углях).
Мы познакомились с двумя теориями адсорбции газов и паров на поверхности твердых адсорбентов — Ленгмюра и Поляни, очень по-разному подходящих к рассмотрению этого процесса. Возникает вопрос, какой отдать предпочтение. Обе они ограничены в применении.
Теория Поляни применима к физической адсорбции молекул адсорбата, теория Ленгмюра охватывает с известными ограничениями и физическую, и химическую адсорбцию адсорбата. Однако она не может быть применима для объяснения адсорбции на пористых адсорбентах с мелкими порами из-за резкой энергетической неоднородности поверхности. Делались попытки обобщить представления Ленгмюра и Поляни. Такая обобщенная теория была развита Брунауэром, Эмметом(*) и Теллером в 1935-40-х гг. прошлого века применительно к адсорбции паров.
.
Б)Теория БЭТ
Брунауэр, Эммет и Теллер создали наиболее общую теорию полимолекулярной адсорбции, в которой описание процессов адсорбции увязывается с представлениями и методами статистической физики.
Авторы теории на основе уравнения Ленгмюра получили приближенное уравнение полимолекулярной адсорбции, которое широко применяется для определения удельной поверхности адсорбента и теплоты адсорбции.
В теории рассматривается адсорбция паров и газов при Т< Ткр.с образованием полимолекулярного слоя вещества на поверхности адсорбента. При Р=Ро идет конденсация пара.
Уравнение Ленгмюра можно использовать только при отсутствии адсорбции веществ сверх монослоя. Это строго: при хемосорбции, физической адсорбции газов при малых Р и Т>Ткр и адсорбции веществ из растворов. Чаще образуются полислои.
Дата добавления: 2016-07-27; просмотров: 5028;











