Електрофоретичні методи аналізу
Електрофорезом називається рух заряджених колоїдних частинок чи молекул високомолекулярних сполук під дією зовнішнього електричного поля. Цей метод дозволяє розділити молекули, що різняться між собою за величиною і знаком заряду високомолекулярних сполук, а також золі колоїдних систем з метою ідентифікації і кількісного їх визначення, а також для встановлення їх молекулярної маси та структури.
Електричні заряди молекул високомолекулярних сполук виникають в результаті дисоціації чи протонизації йоногенних груп. Так, заряд молекул білків являє собою сумарний заряд дисоційованих карбоксильних груп та протонованих аміногруп амінокислот – структурних одиниць білків. Цей загальний заряд може бути позитивний чи негативний. Більшість білків мають у нейтральному розчині негативний заряд. Заряд колоїдних частинок обумовлюється адсорбцією потенціалвизначальних йонів на поверхні ядра. Є колоїди, частинки яких мають позитивний заряд, а інші – негативний.
Величина і знак заряду молекул високомолекулярних речовин і колоїдних частинок залежить від рН середовища.
При пропусканні крізь буферний розчин постійного електричного струму між катодом і анодом створюється градієнт електричної напруги. Заряджені частинки починають рухатися в електричному полі до відповідного електрода.
Інтенсивність руху частинок визначається добутком напруженості електричного поля (Е) і сумарного заряду частинки (Q), якому протистоїть сила в’язкості (Fв), що дорівнює Fв=6πηrv (η-коефіцієнт в’язкості, r-радіус частинки, v-швидкість руху). В стаціонарному стані E∙Q=6πηrv, питома рухливість U=V/E=Q/6πηrv.
Залежно від величини заряду молекули ВМС чи частинки колоїду, їх розмірів, вони мають різну швидкість руху, і це дозволяє розділити суміш досліджуваних речовин на зони однакових частинок, які в електричному полі рухаються з однаковою швидкістю.
V=R∙E, де: R-коефіцієнт пропорційності, який називається електрофоретичною рухливістю і чисельно дорівнює швидкості руху частинки при Е=1В/см.
Якщо припинити дію електричного поля до того, як йони суміші, що досліджується, досягнуть електродів, компоненти цієї суміші розподіляться відповідно до їхньої електрофоретичної рухливості.
Електрофоретична рухливість зростає із збільшенням заряду частинки, величина якого залежить від рН середовища. Чим більші за розмірами (молекулярними масами) молекули ВМС чи частинки колоїдних систем, тим менша їх електрофоретична рухливість. Це пов’язано із зростанням сил тертя та електростатичної взаємодії між частинками менших розмірів. На рухливість частинок також впливає їх форма. Молекули однакових розмірів, однакової величини заряду, але різної форми рухаються в процесі електрофорезу з різною швидкістю.
Параметри електричного поля – напруга, сила струму, опір – також впливають на рухливість молекул ВМС та колоїдних частинок.
При проведенні електрофорезу сила струму повинна бути постійною в даному конкретному випадку розділення речовин, так як це забезпечує відтворюваність результатів. При різних значеннях сили струму положення зон розділених речовин буде різним. Довжина шляху, пройденого зарядженими частинками в електричному полі при постійному значенні сили струму буде залежати від часу проходження струму.
Електрофоретична рухливість пропорційна прикладеній напрузі або градієнту напруги, що вимірюється у В/см. Електрофорез буває низьковольтний (Е=100-500В) та високовольтний (Е=500-10000В) з градієнтами напруги від 20 до 200 В/см.
Електричний опір залежить від йонної сили буферного розчину, в якому відбувається розділення речовин, кількості заряджених частинок, що розділяються, типу та розмірів носія.
У процесі електрофорезу виділяється тепло, кількість якого визначається добутком квадрату сили струму на опір. При постійній напрузі буде збільшуватися електричний струм, якщо електричний опір буде зменшуватися.:
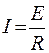 ,
,
що призведе до підвищення температури і випаровування буфера, а також до взаємодії між частинками, що розділяються. Для відведення тепла при електрофорезі апарати обладнуються системою охолодження. Часто для охолодження використовують циркулюючу охолоджену воду.
На електрофоретичну рухливість впливає характер буферу. Для ефективного відведення тепла доцільно застосовувати буфер з низькою електропровідністю, хоча при цьому знижується швидкість міграції частинок в електричному полі.
Зазвичай, використовують буфери з йонною силою, яка лежить в межах концентрації 0,05-0,15 моль/дм3. Це дає можливість вибрати оптимальні значення напруги і сили струму, щоб при цьому нагрів системи не був критичним. Найпоширеніші форміатний, ацетатний, цитратний, фосфатний, трис-буфер та ЕДТА-буфер.
Буфери, які наливають у дві камери, в яких розміщені електроди, як правило, такі ж, які використовують для просочення носія.
Як носії, в порах яких відбувається електрофорез, використовують однорідні і відносно інертні речовини, які просочуються відповідним буфером. Недоліком носіїв є те, що вони проявляють адсорбційну активність і тим самим стримують переміщення зразка в електричному полі. Це призводить до розмивання зон на електрофореграмах, внаслідок чого зразок рухається не у вигляді компактної смуги, а має видовжену форму – з «хвостом», що зменшує чіткість розділення.
Негативно впливає на процес розділення речовин і електроосмос, обумовлений виникненням відносного електричного заряду між молекулами води буферного розчину і поверхнею носія. Внаслідок цього йони гідроксонію з води захоплюють нейтральні речовини. Отримавши позитивний заряд йона Н3О+, ці речовини починають рухатись до катода, а швидкість руху аніонів при цьому знижується. Необхідно вживати заходів для того, щоб потік рідини не виніс досліджувані речовини за межі носія. Крім того, електроосмос спричиняє розширення зон, а це погіршує розділення речовин.
Якщо в якості носіїв використовуються гелі, то в таких носіях негативний вплив на переміщення досліджуваних речовин при електрофорезі має ефект молекулярного сита носія. Гелі мають пори різного розміру, через які можуть проскакувати частинки досліджуваних речовин тільки певних розмірів. Так, у крохмальному, агаровому, поліакриламідному гелі молекули великого розміру рухаються крізь гель тим повільніше, чим менші розміри пор. У такому випадку накладаються як ефект електрофорезу, так і ефект просіювання частинок через молекулярне сито.
Прилади для електрофорезу складаються з джерел постійного струму та електрофоретичного блоку.
Від джерела живлення, що має систему стабілізації напруги і сили струму, високостабільний постійний струм надходить до електрофоретичного блока. Електрофоретичний блок складається з електродів, герметичної камери із органічного скла, буферних камер, а також інших пристроїв у залежності від типу електрофоретичного блоку.
Якщо досліджувані речовини безбарвні, то для визначення їх положення на електрофореграмі їх необхідно фарбувати. Є багато різних барвників для конкретних речовин. Так, білки можна фарбувати бромфеноловим синім з оцтовою кислотою, амідочорним В, дансилхлоридом і ін., полісахариди можна виявляти за реакцією з йодом, ліпопротеїни – суданом чорним в етанолі та ін.
Для кількісного визначення фракції її після забарвлення змивають з електрофореграми відповідним розчинником і визначають оптичну густину екстракту спектрофотометричним чи фотоколориметричним методом. Інколи застосовують сканування електрофореграми за допомогою денситометра. Цей прилад дозволяє вимірювати інтенсивність світла, яке пройшло крізь смужку носія. Інтенсивність цього світла зв’язана оберненою залежністю з кількістю забарвленої речовини у даній фракції на електрофореграмі. Прилад калібрують з використанням таких електрофореграм, які містять відому кількість досліджуваної речовини, нанесеної на носій і обробленої барвником.
Залежно від розмірів частинок, а також завдань їх розділення, електроміграцію поділяють на безпосередньо електрофорез – розділення молекул ВМС та колоїдних частинок; іонофорез – переміщення в електричному полі низькомолекулярних сполук через біологічні мембрани (введення лікарських препаратів у йонному стані крізь шкіру та слизові оболонки); електродіаліз – відділення високомолекулярних сполук від низькомолекулярних; електроосмос – рух йонів крізь напівпроникну перетинку під впливом електричного поля.
Препаративний електрофорез застосовують для виділення значної кількості препарату для подальшого його застосування. Аналітичний електрофорез застосовують для визначення компонентів у суміші, контролю чистоти речовини та ін. За способом розміщення носіїв розрізняють горизонтальний та вертикальний електрофорез.
Залежно від мети досліджень найчастіше застосовують фронтальний електрофорез (або метод рухомої межі), зональний електрофорез (або електрофорез на носії), ізоелектрофокусування, ізотахофорез, імуноелектрофорез.
Кожний з цих методів має ряд модифікацій, які в деяких випадках набувають певної самостійності. Основні з них: електрофорез у градієнті густини, в колонках, в блоці і неперервний (проточний), диск-електрофорез, на носіях –папері, ацетат целюлозі, в тонких шарах, гелях та ін.
Фронтальний електрофорез (метод рухомої межі) полягає в тому, що речовини, які досліджуються, знаходяться в усьому об’ємі буферного розчину, у який занурені електроди. Розташування досліджуваної речовини у міжелектродному просторі в певний час електрофорезу визначають оптичним методом. Визначають у часі розташування межі яка відділяє речовину від розчинника, тобто визначають швидкість руху межі.
Більш широко використовується зональний електрофорез – електрофорез на носії – завдяки високій роздільній здатності, великій швидкості, можливості розділення як частинок колоїдних систем і молекул високомолекулярних сполук, так і неорганічних сполук. Суть методу полягає в тому, що процес електрофорезу відбувається на поверхні та в порах твердого носія. Матеріал носія повинен мати однорідні пори, бути механічно стійким, хімічно інертним по відношенню до буфера та компонентів суміші, що розділяється, мати незначну адсорбційну та електроосмотичну здатність.
Використання носіїв у зональному електрофорезі дуже поширене, але не обов’язкове. Існує електрофорез із стабілізацією зон на певній модифікації проточного електрофорезу, де носії не використовуються.
Адсорбція речовин, що рухаються в електричному полі, на носії призводить до уповільнення їх руху і утворення «хвостів» в електрофоретичних зонах, що ускладнює розділення і кількісний аналіз.
Визначити адсорбційну здатність носія можна попередньо провівши хроматографічне дослідження поведінки даної речовини на носії без впливу електричного поля і встановити кількість речовини, яка утримується на носії.
Як вже зазначалось, існує багато різновидностей носіїв: хроматографічний папір, плівки ацетат целюлози, тонкі шари целюлози, порошки SiO2 та Al2O3, крохмальні, агарозні, поліакриламідні і інші гелі.
Як носій для електрофорезу найпростішим є хроматографічний папір, але він має дуже незначну роздільну здатність у порівнянні з гелями.
Ацетат целюлоза має незначну адсорбційну здатність, що дає можливість розділяти навіть дуже незначні кількості речовин. Цей носій менш гідрофільний, ніж папір, тому він утримує меншу кількість буфера. На цьому носії розділення речовин відбувається швидко.
Тонкі шари целюлози, оксидів Силіцію, Алюмінію та інші наносять на скляні пластинки і просочують буфером. Найбільш високе розділення речовин досягається при застосуванні у якості носіїв гелів. При гель-електрофорезі є незначними адсорбція, електроосмос та розмивання електрофоретичних зон в результаті дифузії. Гель-електрофорез, зазвичай, проводять з аналітичною, а не препаративною метою.
Крохмальні гелі готують при нагріванні й охолодженні частково гідролізованого крохмалю з буфером. Високопористі гелі утворюються при додаванні до буфера менше 2% крохмалю, а низькопористі – від 8 до 15%. У більшості випадків крохмальні гелі наносять на пластинки з поліметилметакрилату для горизонтального чи вертикального електрофорезу.
Агароза – полісахарид, що містить залишки β-D-галактопіранози та 3,6-ангідридо-α-галактопіранози. Гелі утворюються при вмісті агарози в буфері більше 0,3%. Звичайно використовують 2% гелі для електрофорезу, а з вищим вмістом – для гель-фільтрації (як молекулярне сито).
Агар – суміш галактозних полімерів агарози і агаропектину. Вміст цих полімерів у гелі становить 1%. Агарові гелі містять велику кількість води.
Поліакриламідні гелі є найбільш розповсюдженими завдяки дуже добрим характеристикам:
§ розміри пор у цих гелях можна змінювати в широких межах;
§ їх можна використовувати з різноманітними буферами;
§ вони мають дуже низьку адсорбційну здатність і електроосмос;
§ на цих гелях розподіл досліджуваних речовин відбувається швидко з високим розділенням.
Поліакриламідні гелі отримують при полімеризації акриламіду з N,N,N',N'-тетраметилендиаміном та N,N'-метилен-біс-акриламідом у присутності каталізатора (NH4)2SO5 (0,1-0,3%). Поліакриламідні гелі готують із загальним вмістом акриламіду від 3% (пори мають діаметр 0,5 нм) до 30% (пори – 0,2 нм.).
Електрофорез у поліакриламідному гелі проводять у колонках (вертикальних трубочках) або на пластинках.
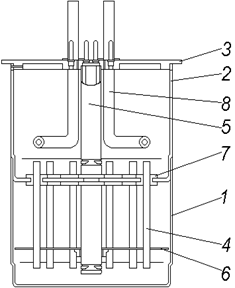
Рис. 10. Камера електрофоретична.
1-стакан; 2-верхня камера; 3-кришка;4-трубка;5-стержень; 6-диск; 7-втулка;
8-змійовик.
Гель, що застосовується для електрофорезу, полімеризується безпосередньо в скляних трубках, які знизу закриваються гумовими втулками і встановлюються у спеціальному штативі. Готовий стовпчик гелю має два шари: нижній – дрібнопористий для розділення суміші на фракції, верхній – крупнопористий для звуження зони суміші перед фракціонуванням. Скляні трубочки в приладі для вертикального гель-електрофорезу, як правило, мають довжину 10см і діаметр 6-8мм. Розчин досліджуваної суміші речовин наносять на поверхню стовпчика гелю або зразок включають у крупнопористу частину гелю при його полімеризації.
Перевагами поліакриламідного гель-електрофрезу є те, що можна варіювати концентрацію складових частин гелю системою буферів та їх складом, концентрацією досліджуваних речовин, рН системи, електричними параметрами процесу та ін.
Як вже зазначалось, роздільна здатність гель-електрофорезу в поліакриламідному гелі дуже велика. Якщо, наприклад, у разі електрофорезу на папері білків сироватки крові виявляється п’ять зон, то електрофорез цього зразка в поліакриламідному гелі дає більше 20 фракцій білків, а кількість досліджуваної проби при цьому треба в 20 разів менше, ніж для електрофорезу на папері.
Поліакриламідний гель є носієм у диск-електрофорезі. В цьому методі використовується неоднорідне переривчасте середовище гелю. На відміну від електрофорезу в однорідному середовищі, при диск-електрофорезі значення рН та розміри пор гелю неоднакові в різних частинах колонки. Верхній шар гелю (концентруючий) має меншу концентрацію і більші розміри пор і готується у буфері з низькою йонною силою та різними значеннями рН. Нижній шар гелю (розділяючий) має малі розміри пор та інші значення рН. У верхньому шарі молекули речовин, що розділяються, завдяки більшим порам рухаються швидше і затримуються менше, ніж у нижньому. Крім того, у верхньому шарі напруженість електричного поля більша завдяки більшому електричному опору, який створює менша йонна сила. Різниця значень рН теж створює ефект більшої швидкості руху речовин, які розділяються, у верхньому шарі.
Все це забезпечує утворення в гелі зон відповідно до компонентів, що розділяються, а саме до концентрації молекул з близькою рухливістю.
Метод диск-електофорезу в поліакриламідному гелі має переваги над іншими методами зонального електрофорезу тому, що в ньому використовується розділення речовин не тільки за їхньою рухливістю в гелі під дією електричного поля, а також в результаті ефекту молекулярного сита та ефекту концентрації.
Для препаративного розділення суміші речовин застосовують також низьковольтний проточний електрофорез. Суть цього методу полягає в наступному. У човник, розташований у верхній частині електрофоретичної камери, вносять забуферений розчин суміші досліджуваних речовин. З човника цей розчин безперервно поступає у верхню частину вертикально розташованого листка фільтрувального паперу певної щільності. Папір попередньо просочується цим же буферним розчином. До боків паперу приєднуються електроди – катод і анод. Розчин речовин, які треба розділити, стікає по паперу вниз під дією сили тяжіння. Проходячи через електричне поле, що діє в перпендикулярному напрямку до руху розчину, вниз, заряджені частинки речовин переміщуються в горизонтальному напрямку до відповідних електродів у залежності від величини їх зарядів з різними швидкостями. Зразок на нижньому краї паперу капає із вирізаних у папері зубців у ряд розміщених пробірок, тобто в пробірках збираються певні фракції розділених речовин.
Цей метод потребує експериментального підбору умов проведення електрофорезу: швидкості току буферного розчину, його складу, рН, визначення місця нанесення зразка та ін. За цим методом отримують фракції білків, пептидів, амінокислот, інших невеликих молекул.
Для того, щоб виключити можливу адсорбцію речовин на папері, застосовують метод проточного електрофорезу без носія. Для цього буферний розчин з розчиненими в ньому речовинами, які треба розділити, постійно тече з резервуару між дуже близько розташованими скляними пластинками, до боків яких приєднуються електроди, з’єднані з відповідними полюсами джерел постійного струму. Через ряд конічних отворів на нижньому кінці пластинок відбираються різні фракції.
Таким чином, електрофорез у тонкому шарі рідини (проточний електрофорез у вільному середовищі) є різновидністю зонального електрофорезу без середовища підтримки.
При розділенні речовин методом електрофорезу низькомолекулярних речовин доцільно використовувати високовольтний електрофорез (електрична напруга – до 10000 В, сила струму – до 500 мА). За таких умов значно поліпшується розділення і процес протікає швидше. Однак при високовольтному електрофорезі виділяється велика кількість тепла і це потребує спеціальних методів охолодження. Найчастіше для охолодження використовують дві алюмінієві пластини, які через ізолюючі прокладки з поліетилену притискаються з двох боків до листка носія. Розміри цих пластин досягають 50×50 см, мають канали для циркуляції води на зразок пластин морозильних камер холодильників.
У методі ізотахофорезу всі заряджені молекули в електричному полі рухаються з однаковою швидкістю. Спочатку вони розподіляються відповідно до величини заряду і рухливості, а потім переміщуються в електричному полі з однаковою і постійною швидкістю. Цей метод має дуже високу розподільну здатність і використовується як для аналітичного, так і для препаративного розділення речовин. В основі цього методу лежить принцип фронтального електрофорезу (метод рухомої межі). В залежності від конструкції наявного обладнання, розділення проводять у горизонтальному або вертикальному напрямках. Розчин, в якому відбувається розділення, містить, як правило, сахарозу для забезпечення більшої щільності. Суть ізотахофорезу полягає в наступному. Зразок вводять між ведучим електролітом, який містить йони з більшою рухливістю, ніж йони досліджуваних речовин, і замикаючим електролітом, який містить йони з меншою рухливістю, ніж йони зразка. Йони речовин, які розділяються, а також йони ведучого і замикаючого електролітів мають однаковий знак заряду. Для досягнення необхідних значень рН і буферної ємності розчини зразка, ведучого та замикаючого електролітів мають відповідні протиіони. В електричному полі всі заряджені йони спочатку рухаються зі швидкістю, яка визначається напруженістю електричного поля, величиною заряду і рухливістю. Ведучі йони, які мають високу рухливість, рухаються з більшою швидкістю і накопичуються в зоні анода (якщо вони заряджені негативно). Зона ведучих йонів характеризується підвищеною концентрацією йонів з високою рухливістю. Відповідно до цього вона матиме найменший електричний опір, що спричинить низьку напруженість електричного поля. Зона ведучих йонів має також низьке значення рН і меншу температуру.
Внаслідок зменшення концентрації ведучих йонів за межами їхньої зони підвищується електричний опір у системі, що призводить до підвищення напруженості електричного поля, у зв’язку з чим підвищується швидкість міграції йонів досліджуваних речовин, які рухаються слідом за ведучими йонами.
Ведучі йони та йони речовин, які розділяються, майже не змішуються. Коли певна частина йонів досліджуваного зразка все ж таки потрапить у зону ведучих йонів, яка характеризується низькою напруженістю електричного поля через велику концентрацію йонів з високою рухливістю, то швидкість йонів зразка різко зменшиться і вони відстануть від ведучих йонів; якщо ж ведучі йони попадуть у зону йонів зразка, то внаслідок високої напруженості електричного поля в цій зоні швидкість руху їх різко збільшиться, і вони опиняться в характерній для них зоні. Таким чином, внаслідок того, що зона йонів речовин, які розділяються, характеризується нижчою концентрацією йонів і меншою, ніж у ведучих йонів рухливістю, але більшою напруженістю електричного поля і вищим значенням рН, відбувається автоматична стабілізація між зонами.
За йонами досліджуваного зразка рухаються замикаючі йони, які мають менший електричний заряд і рухливість, ніж йони зразка. Для них йони зразка є ведучими, тому вони не здатні їх випередити і також спричиняють звуження зони зразка.
У міру звуження зони зразка концентрація йонів у ній підвищується, відповідно зменшується її електричний опір, що призводить до падіння напруженості електричного поля в цій зоні. Такий процес буде відбуватися до моменту стабілізації системи, коли швидкість руху всіх йонів – ведучих, зразка і замикаючих – стане рівною. Йони зразка будуть «стиснутими» між ведучими і замикаючими йонами у вузькій зоні, ширина якої та концентрація в ній йонів значною мірою залежить від концентрації та рухливості ведучих йонів.
Якщо зразок містить декілька йонів з різною рухливістю, то вони будуть розміщуватися між замикаючими і ведучими йонами в міру зменшення їхньої рухливості у вигляді дискретних зон, які контактують між собою, але містять тільки певні йони. Після досягнення рівноваги і розділення йонів зразка в системі виникає градієнт рН, напруженості електричного поля і температури.
У випадку, коли рухливості йонів зразка близькі, роздільну здатність ізотахофорезу можна підвищити шляхом внесення у зразок амфолітів. Їх підбирають таким чином, щоб вони мали проміжну рухливість порівняно з йонами зразка і розміщувалися між ними, що підвищує розділення.
Для аналізу низькомолекулярних йонів органічних речовин використовують, як правило, аналітичний ізотахофорез у скляних або пластмасових трубочках (капілярах) завдовжки 50-100см і з внутрішнім діаметром 0,4-0,6мм. Як розділяючі йони використовують відповідні амфоліти, а також валін, аланін та інші речовини.
Оскільки в зонах розділення створюються різні градієнти електричної напруги, в них виділяється неоднакова кількість тепла – чим менша напруженість електричного поля, тим менше виділяється тепла. Це явище використовується для виявлення зон при ізотахофорезі, для чого вимірюють їхню температуру термометром, термопарою, термістором тощо. Дя визначення зон при ізотахофорезі використовують також детектори провідності градієнта електричного потенціалу (мікроелектроди). Речовини, які здатні поглинати ультрафіолетове випромінювання, можна реєструвати високочутливими детекторами в цій області.
§ 84. Запитання для самоперевірки та контрольні запитання
з електрохімічних методів аналізу
1. Наведіть класифікацію електрохімічних методів аналізу.
2. За яким показником проводиться аналіз вмісту досліджуваної речовини в кондуктометрії?
3. Чим обумовлена електропровідність розчинів електролітів?
4. Чим обумовлений опір електропровідності у розчинах електролітів?
5. Наведіть математичне вираження питомої електропровідності розчину.
6. Чому питома електропровідність розчину електроліту збільшується із зростанням концентрації розчину до певної межі, а потім знижується?
7. Що таке еквівалентна електропровідність розчину електроліту?
8. Як зв’язані між собою еквівалентна, питома електропровідності і концентрація розчину електроліту?
9. Що таке гранична електропровідність розчину електроліту і від яких факторів вона залежить?
10. Чим пояснюється зменшення еквівалентної електропровідності розчинів сильних електролітів?
11. У чому суть закону Кольрауша щодо електропровідності розчинів електролітів?
12. Чим пояснюється аномально висока рухливість гідроген-іонів та гідроксид-іонів у водних розчинах електролітів?
13. Чим пояснюються ефекти деформаційної та орієнтаційної поляризації у розчині, що знаходиться в електричному полі високої частоти?
14. Які є типи кондуктометричних комірок?
15. У чому суть низькочастотного кондуктометричного титрування? Яка область його застосування?
16. У чому суть прямої кондуктометрії?
17. Що таке високочастотне кондуктометричне титрування і чим воно відрізняється від низькочастотного? У яких випадках застосовують високочастотне кондуктометричне титрування?
18. На чому ґрунтуються потенціометричні методи аналізу?
19. Навести математичне вираження величини потенціалу індикаторного електрода.
20. Що таке електрод порівняння і які бувають види таких електродів?
21. Які бувають види індикаторних електродів?
22. Опишіть будову і принцип дії скляного індикаторного електрода.
23. За яким принципом вибирають електроліт для сольового містка у гальванічному елементі?
24. У чому суть прямої потенціометрії?
25. З якою метою у досліджуваний та стандартний розчини у прямій потенціометрії вводять надлишок індиферентного електроліту?
26. У чому суть потенціометричного титрування і в яких випадках застосовується цей метод?
27. На чому базується метод полярографічного аналізу?
28. Що таке концентраційна поляризація електрода?
29. Що таке дифузійний або граничний струм у полярографії? Яку інформацію дає величина такого струму?
30. У чому переваги полярографічного методу аналізу над іншими методами?
31. Яку інформацію для дослідника дає полярографічна хвиля?
32. Який параметр полярографічної хвилі використовується для ідентифікації досліджуваної речовини?
33. Які електроди застосовуються в полярографах?
34. Що таке полярографічний фон і для чого він застосовується?
35. Які вимоги повинні задовольняти індиферентні електроліти, що застосовуються в полярографії?
36. Які області застосування полярографічного аналізу?
37. У чому суть методу амперометричного титрування?
38. У чому переваги амперметричного титрування над полярографією?
39. У чому суть кулонометричного аналізу?
40. Який закон лежить в основі кулонометричного аналізу? Дати математичне вираження цього закону.
41. Який найбільш важливий показник суттєво відрізняє кулонометричний аналіз від інших методів аналізу?
42. Який параметр процесу в кулонометричному аналізі слід строго дотримувати?
43. Якими методами визначається момент кількісного завершення електрохімічної реакції в кулонометричному аналізі?
44. У чому суть методу кулонометричного титрування?
45. У чому переваги кулонометричного титрування над звичайним титруванням?
46. Якими методами визначають кількість електрики, яка необхідна для протікання електрохімічної реакції, в кулонометрії?
47. У чому сутність електрофоретичних методів аналізу?
48. Які параметри заряджених частинок та параметри електричного поля визначають швидкість руху частинок в електричному полі?
49. Як впливає характер буферу на електрофоретичну рухливість частинок?
50. Які вимоги пред’являються до носіїв, в порах яких відбувається електрофорез ?
51. Якими способами виявляють фракції речовин на електрофореграмах?
52. У чому сутність іонофорезу?
53. Для яких цілей застосовують препаративний та аналітичний електрофорези?
54. У чому сутність фронтального та зонального електрофорезів та які області їх застосування?
55. У чому сутність і техніка виконання електрофорезу в поліакриламідному гелі?
56. У чому сутність ізотахофорезу та в яких випадках він застосовується?
Розділ 16
Хроматографічні методи аналізу
Групу речовин, що мають подібні хімічні властивості, практично не можна розділити за допомогою хімічних реакцій, оскільки для цього не існує специфічних реагентів. Для розділення подібних речовин застосовують фізико-хімічні методи, які ґрунтуються на розчинності речовин у різних розчинниках, адсорбції, йонному обміні та ін.
Хроматографія була відкрита російським ботаніком М.С. Цвєтом у 1903р. і використана ним для розділення суміші рослинних пігментів. Цвєт застосовував адсорбційний метод хроматографії, який полягає у тому, що при пропусканні будь-якого розчину крізь високу та порівняно вузьку колонку, наповнену адсорбентом, речовини поглинаються залежно від ступеня їх адсорбованості у певній послідовності і в той же час оборотно.
Отриману хроматограму проявляють, пропускають крізь неї деяку кількість розчинника, як правило, того ж, у якому була розчинена досліджувана речовина. Для кожного компонента суміші у цій двофазній системі характерна рівновага, завдяки чому на стовпці адсорбенту утворюються горизонтальні зони певної висоти, які переміщуються вниз, вздовж колонки, по шляху руху проявляючої рідини зі швидкістю, яка залежить від здатності даної речовини поглинатися адсорбентом, що міститься у колонці. Оскільки здатність адсорбуватися у різних речовин різна, то зони більш-менш чітко відділяються одна від іншої.
Найважливішою перевагою хроматографічних методів над іншими є те, що при цьому речовини, як правило, хімічно не змінюються. Крім того, хроматографічний метод застосовується для розділення газоподібних та рідких речовин.
Є багато видів хроматографії. Їх класифікація базується на різних критеріях.
За принципом фракціонування та фізико-хімічної взаємодії адсорбенту та речовин розрізняють:
§ адсорбційну хроматографію на колонці чи в тонкому шарі;
§ розподільну хроматографію на папері, у тонкому шарі;
§ газорідинну;
§ молекулярно-ситову;
§ йоннообмінну хроматографію на папері та на колонці;
§ гель-фільтрацію.
За природою та розташуванням нерухомої фази види хроматографії бувають:
§ на папері;
§ на колонці;
§ на плівці;
§ в тонкому шарі;
§ в товстому шарі.
У залежності від агрегатного стану фаз хроматографічні методи поділяються на:
§ рідинну хроматографію;
§ газову хроматографію;
§ газорідинну хроматографію.
За способом елюції хроматографія на колонці буває:
§ проявна (елюентна);
§ фронтальна;
§ витискувальна.
За напрямком руху елюента розрізняють:
§ висхідну хроматографію;
§ низхідну хроматографію.
Будь-яка хроматографічна система базується на розподілі компонентів між двома фазами, з яких одна нерухома з великою поверхнею, а друга переміщується відносно першої. Як нерухома фаза використовується тверда речовина або рідина, що наноситься на твердий носій. Компоненти, що розділяються, разом з рухомою фазою (рідиною або газом) проходять крізь нерухому.
Речовини в суміші можуть розділятися за рахунок встановлення рівноважного розподілу між нерухомою рідкою та рухомою рідкою фазами (протиточне розподілення, паперова хроматографія) або між нерухомою рідкою та рухомою газовою фазами (газорідинна хроматографія); адсорбційної рівноваги між нерухомою твердою та рухомою рідкою фазами (адсорбційна хроматографія); йонообмінної рівноваги між йонообмінною смолою (нерухома фаза) та електролітом (рухомою фазою) (йонообмінна хроматографія); рівноваги між рідкою фазами на внутрішній та зовнішній поверхні пористої структури (гель) (молекулярно-ситова хроматографія).
Дата добавления: 2020-10-14; просмотров: 642;











