Потенціометричні методи аналізу
Потенціометричний метод ґрунтується на визначенні електрорушійної сили гальванічного елемента, що складається з індикаторного електрода та електрода порівняння, в залежності від концентрації у розчині електроліту (активності у розчині електроліту) досліджуваного йона.
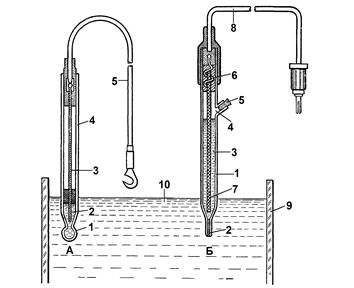
Рис.5. Електродна система для визначення активності йонів у досліджуваному розчині:
А – індикаторний електрод; Б – електрод порівняння
| 1 – кулька із йонселективного скла; 2 – розчин 0,1 М НСl; 3 – хлорований срібний дріт; 4 – скляний балон; 5 – вивідний контакт індикаторного електрода | 1 – скляний корпус; 2, 7– азбестова нитка; 3 – насичений розчин КС1; 4 – отвір для заливки КСl; 5 – гумова пробка; 6 – хлорований срібний дріт; 8 – вивідний контакт електрода порівняння; 9 – стаканчик; 10 – досліджуваний розчин |
Індикаторним називається електрод, потенціал якого залежить від концентрації досліджуваного розчину (активності досліджуваного йона) і визначається за рівнянням Нернста:
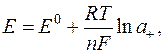
де Е0 – стандартний електродний потенціал – потенціал електрода відносно розчину, де відповідні йони мають активність, що дорівнює одиниці;
R – універсальна газова стала;
T – абсолютна температура;
F – стала Фарадея F ≈ 96491 Кулон/моль-екв.
n – заряд досліджуваного йона;
a+ – активність досліджуваного йона.
У розведеному розчині замість активностей можна взяти концентрації.
Підставляючи значення R, F, взявши температуру T=298К (25°C) і перейшовши до десяткових логарифмів, отримаємо:
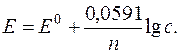
Електродом порівняння називається електрод, потенціал якого має постійне значення.
Основним електродом порівняння є стандартний водневий електрод, для якого прийнято вважати Е0=0 В.
Працювати з водневим електродом незручно. Простіше працювати з каломельним електродом порівняння, оскільки його потенціал відносно водневого електрода точно відомий.
Як електрод порівняння можна використати хлоросрібний електрод. Хлоросрібний електрод складається із срібного дроту, покритого рівномірним шаром AgCl у розчині, що містить KCl насичений розчин.
Електроди порівняння є слабко поляризованими, потенціал яких не змінюється під час проведення потенціометричного вимірювання, а зміна електрорушійної сили електродної пари буде залежати тільки від потенціалу другого електрода пари – індикаторного електрода.
Індикаторні електроди можуть бути металеві та мембранні. До мембранних йонселективних електродів відносяться скляні, з рідкими, твердими мембранами.
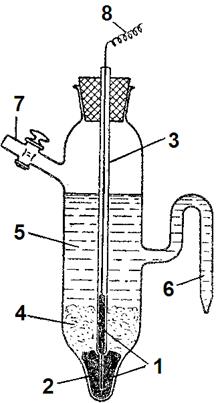
Рис. 6. Каломельний електрод.
1 – шар ртуті; 2 – платиновий дріт для контакту; 3 – скляна трубка;
4 – паста з каломелі; 5 – насичений розчин KCl; 6 – сифон; 7 – бокова трубка;
8 – мідний дріт для включення електрода до приладу.
Скляні електроди виготовляються з тонкого літієво-кальці-алюмосилікатного скла у вигляді кульки. Всередині електрода розташований електрод порівняння, занурений у розчин з фіксованим pH. Загальний потенціал скляного електрода складається з трьох потенціалів: потенціалу внутрішнього електрода порівняння, потенціалу асиметрії та потенціалу, обумовленого різницею концентрацій H+ по обидва боки скляної мембрани. При цьому величини двох перших потенціалів є сталими для певного електрода. Величина третього потенціалу є змінною, оскільки при зануренні скляної мембрани в розчин йони Na+ із скла в процесі йонного обміну заміщуються еквівалентною кількістю йонів H+ з розчину. Таким чином, скляна мембрана являє собою електрод, який є оборотним стосовно йонів H+ і, отже, може бути використаний для вимірювання концентрації йонів H+, тобто pH розчину.
Електрохімічний ланцюг має такий вигляд:
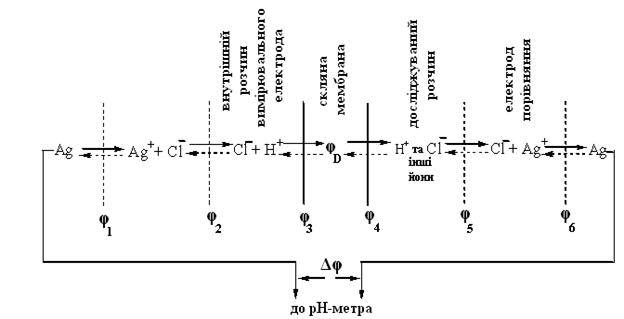
Рис.7. Електрохімічний ланцюг.
φ4 описується законом Нернста.
Електрорушійна сила ланцюга дорівнює різниці потенціалів електрода порівняння та індикаторного електрода:
ЕРС = Eпор–Еінд+Ед,
Де Ед – дифузійний потенціал, що виникає на межі розділу двох рідинних фаз електрохімічного ланцюга.
Для сольового містка використовують солі з близькими значеннями рухливості катіона та аніона. Найчастіше це насичений розчин KCl. У такому разі Ед практично дорівнює нулю.
Потенціометричні методи аналізу поділяються на пряму потенціометрію або йонометрію та потенціометричне титрування.
Пряма потенціометрія (йонометрія) базується на визначенні концентрації досліджуваного йона за величиною ЕРС електрохімічного ланцюга з індикаторним електродом, селективним до цього йона. Для цього вимірюють ЕРС ланцюга із стандартними розчинами та будують графік у координатах: ЕРС–lgс. Потім вимірюють ЕРС ланцюга з досліджуваним розчином і за графіком визначають концентрацію. У стандартні та досліджувані розчини попередньо вводять індиферентний електроліт з високою концентрацією для утворення постійної йонної сили розчину.
У деяких випадках градуюють шкалу не у значеннях ЕРС, а безпосередньо у pH чи pNa, pK та ін.
Потенціометричний метод визначення концентрації йонів у розчині за допомогою йон-селективних електродів ґрунтується на вимірюванні електрохімічного потенціалу, зануреного в досліджуваний розчин зворотного електрода.
Вимірювання потенціометричним методом здійснюється при використанні електродів, які допомагають встановити процес перенесення або розділення зарядів, що виникають на межі розділу фаз.
При зануренні такого електрода в розчин електроліту, який містить однойменний із металом йон, виникає різниця потенціалів між електродом і розчином, яка залежить від активності йона металу.
Якщо електрод вкрити тонким шаром важкорозчинної сполуки (наприклад, Ag/AgCl), яка занурена в розчин з однойменним аніоном, то різниця потенціалів залежатиме від активності відповідного аніона в розчині.
У разі, якщо шар важкорозчинної сполуки містить другий катіон, який утворює з аніоном також важкорозчинну сполуку, але з більшою розчинністю, ніж розчинність сполуки металу електрода (наприклад, Ag/Ag2S/CuS), різниця потенціалів буде залежати від активності другого катіона в розчині. Такі електроди дозволяють селективно визначати будь-який йон за наявності інших йонів у розчині.
Цей вид електродів виготовляється на основі напівпроникності мембран, які характеризуються підвищеною вибірковістю відносно певного типу йонів. Мембрана може бути гомогенною (монокристал, скло) і гетерогенною. У цьому випадку кристалічна речовина міститься в плівці полімеру.
Потенціометричне титрування ґрунтується на визначенні точки еквівалентності за зміною ЕРС потенціометричної комірки у ході титрування.
Точку еквівалентності визначають за інтегральною кривою титрування, яку будують у координатах: ЕРС–VТ (об’єм титранту). У точці еквівалентності спостерігається перегин кривої титрування.
Будують диференційну криву титрування у координатах: 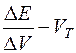 , де ΔЕ – зміна ЕРС при зміні об’єму титранту ΔV; точка еквівалентності визначається як максимум кривої титрування.
, де ΔЕ – зміна ЕРС при зміні об’єму титранту ΔV; точка еквівалентності визначається як максимум кривої титрування.
Потенціометричне титрування дозволяє визначати точку еквівалентності при титруванні непрозорих і забарвлених розчинів. З електрохімічних методів потенціометричні методи аналізу використовуються найчастіше; вони можуть бути повністю автоматизовані.
Полярографія
Полярографічний метод дослідження запропонував у 1922р. чеський хімік Ярослав Гейровський.
Метод ґрунтується на вивченні явищ, які відбуваються на крапельно-ртутному катоді. Назва методу пов’язана з процесами поляризації, які виникають при пропусканні електричного струму крізь розчини електролітів.
У досліджуваний розчин опускають два електрода; один з них, як правило катод, має малу поверхню, наприклад краплю ртуті, що витікає з дуже тонкого капіляра. Анод являє собою шар ртуті з великою поверхнею на дні електролітичної посудини. Електроди сполучають з джерелом постійного струму і поступово підвищують напругу, спостерігаючи за зміною сили струму в залежності від прикладеної напруги. Ця залежність має нерівномірний характер і виражається кривою з перегинами – хвилями. Напруга, при якій виникають ці хвилі, залежить від складу електроліту і характерна для того чи іншого катіона. Висота цих хвиль залежить від концентрації йона, який відновлюється на катоді. Таким чином, за кривою залежності сили струму від прикладеної напруги в даних умовах можна визначити склад і концентрацію електроліту, тобто провести якісний та кількісний аналіз розчину.
В основі полярографії лежить автоматична реєстрація сили струму при поступовому збільшенні напруги на електродах, занурених у досліджуваний розчин. У полярографічному методі використовується явище концентраційної поляризації, яка виникає на електроді з малою поверхнею при пропусканні електричного струму крізь розчин електролітів. Зі збільшенням різниці потенціалів між електродами зростає сила струму, що проходить крізь розчин, та щільність струму на малому електроді. При цьому швидкість збідніння розчину в безпосередній близькості до поверхні малого електрода зростає, як і зростає опір проходженню струму на межі електрод – розчин.
У цілому, настає такий період, коли подальше підвищення різниці потенціалів не викликає помітного зростання сили струму, що проходить крізь розчин.
При сталій рухомій рівновазі, коли кількість відновлених йонів починає дорівнювати кількості йонів, що продифундували до ртутного катода, сила струму стає постійною. Таку силу струму, при якій досягається повний розряд усіх йонів досліджуваної речовини, які надходять у приелектродний простір за рахунок дифузії, називають дифузійним або граничним струмом. Швидкість дифузії речовини з розчину з вищою концентрацією у розчин з нижчою концентрацією пропорційна різниці концентрацій обох розчинів. Тому дифузійний струм пропорційний концентрації йона, що визначається, в розчині.
Чутливість полярографічного методу визначається величиною ємнісного струму та становить 10–5моль/дм3, а відносна похибка визначень становить 3%. Це дозволяє досліджувати значно розведені розчини та невеликі об’єми – до 0,1-0,02см3. Висока чутливість методу та швидкість аналізу дає можливість одночасно визначити якісний та кількісний склад досліджуваного розчину.
Полярографічний метод можна застосовувати при дослідженні сумішей без попереднього розділення речовин.
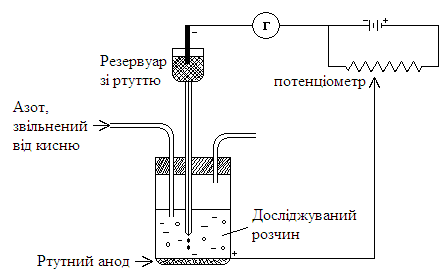
Рис. 8. Принципова схема полярографічної установки.
Вихідний отвір капіляра – 0,02-0,03мм.
Швидкість витікання ртуті з капіляра – 1 крапля за 3-5с.
Поверхня ртуті на дні електролізера значно більша за поверхню краплі катода, і при проходженні невеликих за величиною струмів потенціал анода залишається постійним, тобто електрод не поляризується.
Для полярографічних досліджень, як правило, використовуються автоматичні електронні полярографи, в яких полярографічні криві записуються за допомогою самописця. Ці прилади мають високу чутливість, роздільну здатність і точність.
Залежність сили струму від напруги (полярограма) складається з декількох етапів. Спочатку сила струму незначна, але в міру зростання напруги вона зростає, оскільки заряджається ртутно-крапельний електрод, і електроліз не відбувається.
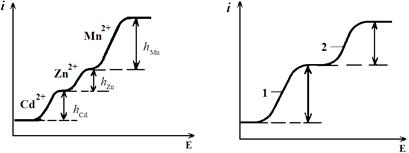
Рис. 9. Типові полярографічні хвилі.
Невелике збільшення різниці потенціалів до значення, при якому відновлюється йон, призводить до того, що в цій частині невелике зростання напруги супроводжується значним збільшенням сили струму. При більш значному збільшенню напруги сила струму досягає деякої постійної величини. Пов’язано це з тим, що всі йони речовини, що їх аналізують, у приелектродному шарі встигають розрядитися, і при цьому швидкість дифузії йонів відстає від швидкості розрядження йонів на катоді. У випадку, коли потенціал продовжує зростати до величини, при якій починається розрядка іншого різновиду йонів, виникає нова хвиля. Таким чином, висота полярографічної, або вольтамперної, хвилі характеризує граничний (дифузійний) струм, прямо пропорційний концентрації речовини, яка визначається.
При якісному аналізі зручним є використання потенціалу напівхвилі (потенціал середини полярографічної кривої, Е½), величина якого не залежить від концентрації досліджуваного електроліту, а залежить від природи йона, що відновлюється, і його можна використати для ідентифікації досліджуваної речовини.
Полярографічні хвилі властиві тим речовинам, які здатні відновлюватися чи окиснюватися на ртутно-крапельному електроді й утворювати солі з ртуттю.
Для аналізу інших речовин використовуються електроди іншої природи (вугільні, срібні, платинові) або застосовуються певні хімічні реакції, які відбуваються на електроді та здатні змінювати силу струму (кінетична хвиля).
Для збільшення електропровідності досліджуваного розчину, а також для пригнічення міграційного струму (переміщення йонів під дією електростатичного поля катода) застосовується індиферентний електроліт (фон), електроліз якого настає при більшій різниці потенціалів, ніж це потрібно для речовини, що визначається. Такі електроліти, що додаються до розчину, який аналізується, називаються полярографічним фоном. Застосування того чи іншого індиферентного електроліту залежить від розчинності та стійкості в ньому досліджуваної речовини. Індиферентний електроліт не повинен реагувати з досліджуваною речовиною і брати участь у електрохімічних процесах на електроді. Як індиферентні електроліти використовуються розчини солей лужних та лужноземельних металів, амонію, луги, кислоти в концентраціях, які набагато перевищують концентрацію речовини, що визначається.
Полярографічний метод дозволяє досліджувати як неорганічні, так і органічні речовини, здатні окиснюватися або відновлюватися на поверхні електродів при проходженні постійного електричного струму. За допомогою полярографії можна виявляти наявність і концентрацію амінокислот, гормонів, вітамінів, багатьох фармацевтичних препаратів.
Дата добавления: 2020-10-14; просмотров: 859;











