Нефелометричний та турбідіметричний методи аналізу
Нефелометричний та турбідіметричний методи застосовують для аналізу суспензій, емульсій і інших мутних середовищ. Інтенсивність світлового потоку, що проходить крізь такі середовища, зменшується внаслідок розсіювання та інших процесів взаємодії світла із завислими частинками.
Суть нефелометричного та турбідіметричного методів аналізу полягає в тому, що досліджуваний компонент переводять у малорозчинну сполуку, яка знаходиться в рідині в завислому стані, та вимірюють інтенсивність розсіяного світла або послаблення світлового потоку цією суспензією.
Якщо вміст речовини знаходять за інтенсивністю розсіяного світла, то такий метод називається нефелометричним. Метод визначення вмісту речовини за послабленням суспензіями світлового потоку називається турбідіметричним. У даних методах аналізу інтенсивність світлового потоку змінюється, але спектральна характеристика його залишається постійною.
У нефелометрії та турбідіметрії застосовують реакції осадження, основними вимогами до яких є утворення практично нерозчинного продукту реакції, який повинен знаходитися не у вигляді осаду, а у вигляді завислих частинок (суспензії).
Світло розсіюється частинками, розміри яких більші за довжину хвилі світла, яке падає на них. Інтенсивність розсіяного світла цими частинками описується законом Релея:
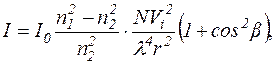
де n1 і n2 – показники заломлення частинок та середовища відповідно;
N – загальне число світлорозсіюючих частинок
Vi – об’єм частинки, що розсіює світло (форма частинки приймається за кулю);
λ – довжина хвилі падаючого світла;
r – відстань до приймача розсіяного світла;
β – кут між падаючим та розсіяним світлом.
За наявності в суспензії крупних частинок, діаметр яких вимірюється десятками нанометрів, закон Релея не виконується. У такому разі зв'язок між концентрацією та інтенсивністю світлорозсіювання установлюють за калібрувальними графіками. При дослідженні заданої системи показники заломлення n1 і n2 залишаються постійними, величини r і β визначаються конструкцією приладу і теж не змінюються. За цих умов рівняння набуває вигляду:
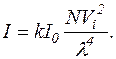
З цієї формули видно, що чим менша довжина хвилі падаючого світла, тим інтенсивніше розсіюється світло частинками суспензії.
Концентрація, за визначенням, є числом частинок в одиниці об’єму:
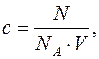
де V – об’єм суспензії;
NА – постійна Авогадро;
N – загальне число світлорозсіюючих частинок.
Підставляючи значення c у рівняння 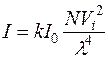 , отримуємо:
, отримуємо:
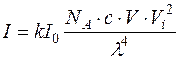 .
.
При постійних значеннях об’єму суспензії V, об’єму світлорозсіюючої частинки Vi, довжини хвилі падаючого світла λ рівняння набуває вигляду:
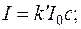 або
або 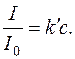
Рівняння показує, що відношення інтенсивності розсіяного світла до інтенсивності падаючого пропорційно концентрації завислих частинок.
Для вимірювання інтенсивності розсіяного світла користуються приладами нефелометрами, які мало відрізняються від фотоелектроколориметрів, а послаблення світлового потоку в турбідіметрії вимірюється фотоелектроколориметрами.
Методами нефелометрії та турбідіметрії визначають дуже малі концентрації йонів, які утворюють малорозчинні сполуки. Так, сульфат-іони визначають у вигляді суспендованого барій сульфату, хлорид-іони – у вигляді завислого у воді аргентум хлориду та ін.
Нефелометрія та турбідіметрія відзначаються високою чутливістю, що важливо по відношенню до тих елементів або йонів, для яких відсутні кольорові реакції та неможливо застосувати колориметричні методи.
§ 77. Запитання для самоперевірки та контрольні запитання
з оптичних методів аналізу
1. У яких діапазонах довжин хвиль електромагнітного випромінювання знаходиться ближня ультрафіолетова область, видима область, ближня інфрачервона область?
2. За яких умов атомом чи молекулою відбувається поглинання або випромінювання світла певної довжини хвилі?
3. Що означають величини Е1 та Е2 у рівнянні Е = Е1 − Е2 = hν ?
4. Як називається група атомів у молекулі, що дає вклад у спектр її поглинання, тобто здатна поглинати електромагнітне випромінювання?
5. Що таке батохромний і гіпсохромний ефекти?
6. Що таке коефіцієнт світлопропускання поглинаючого середовища? Наведіть відповідну формулу вираження цієї величини.
7. Що таке величина поглинання або екстинкції поглинаючого середовища? Наведіть відповідну формулу вираження цієї величини.
8. Наведіть вираження основного закону фотометрії Бугера-Ламберта-Бера. Які залежності він встановлює?
9. Що таке оптична густина поглинаючого середовища і як вона позначається?
10. Який фізичний зміст коефіцієнта молярної екстинкції речовини, що поглинає світло, при певній довжині хвилі падаючого світла?
11. Чому при визначенні концентрації розчиненої речовини за величиною оптичної густини розчину слід брати тільки розведені розчини?
12. За яких умов буде мати місце нелінійна залежність між величиною екстинкції і молярною концентрацією розчину?
13. Що таке монохроматичне світло? Який обов’язковий параметр треба вказувати, застосовуючи значення молярного коефіцієнта екстинкції?
14. Яким чином у спектрофотометрії досягається монохроматичне світло? Якого типу бувають такі пристрої?
15. Які найбільш важливі параметри монохроматорів?
16. Які кювети у спектрофотометрах застосовують при роботі у ближній УФ-області?
17. Які пристрої використовують для перетворення світлової енергії в електричні сигнали у спектрофотометрах і фотоелектроколориметрах?
18. Чим відрізняється фотоколориметрія від спектрофотометрії?
19. Чому у фотоколориметрії закон Бугера-Ламберта-Бера виконується не повністю?
20. Від яких факторів залежить точність аналізу у фотоколориметрії?
21. За яким принципом вибирають світлофільтри у фотоколориметрії?
22. Назвіть види люмінесценції та дайте коротку характеристику їх.
23. На чому базується фотоколориметричний аналіз?
24. У чому сутність закону Стокса-Ломмеля?
25. Що таке енергетичний і квантовий виходи люмінесценції?
26. За яких умов буде надійніше визначення речовини флуоресцентним методом?
27. Від яких факторів залежить інтенсивність флуоресценції?
28. На якому показнику базується рефрактометричний аналіз?
29. Від яких факторів залежить величина відносного показника заломлення?
30. 30. Яким чином позначається значення температури і довжини хвилі світла, при яких вимірювався відносний показник заломлення?
31. Яка залежність існує між концентрацією розчину речовини та відносним показником заломлення світлового променя, що падає на цей розчин?
32. У чому сутність поляриметричного аналізу?
33. Що таке поляризоване світло і що таке площина поляризації поляризованого світла?
34. Які речовини називаються оптично активними і як це позначається?
35. З чим пов’язана оптична активність речовин?
36. Від чого залежить величина кута обертання площини поляризації поляризованого світла?
37. За якою формулою розраховують концентрацію в розчині оптично активної речовини у поляриметрії?
38. Яку величину використовують для ідентифікації оптично активних речовин?
39. На чому базується інтерферометричний метод аналізу?
40. Як пов’язано зміщення смуг інтерференції з показником заломлення досліджуваного розчину?
41. У чому сутність емісійного спектрального аналізу?
42. Якими способами збуджують атоми і молекули у емісійному спектральному аналізі?
43. Що таке спектр емісії і які бувають емісійні спектри?
44. Що таке полум’яна фотометрія і яка область її застосування?
45. Що таке резонансні лінії і які їх недоліки?
46. Як здійснюється ідентифікація елемента за спектральним аналізом? Які лінії спектру використовуються для якісного аналізу?
47. Які розрахунки лежать в основі кількісного спектрального аналізу?
48. Чому резонансні лінії малопридатні для кількісного визначення елемента в пробі?
49. За лініями яких довжин хвиль проводиться визначення Натрію і Калію за методом полум’яної фотометрії?
50. Які пристрої використовують для виділення випромінювання з певною довжиною хвилі у полум’яній фотометрії?
51. У чому суть атомно-абсорбційного спектрального аналізу?
52. У чому відмінність між емісійною і атомно-абсорбційною спектроскопією?
53. Які джерела випромінювання застосовуються в атомно-абсорбційній спектроскопії?
54. Яка область застосування атомно-абсорбційної спектроскопії?
55. У чому суть турбідіметричного та нефелометричного методів аналізу?
56. Які реакції придатні для кількісного визначення речовин методами турбідіметрії та нефелометрії?
57. За яким законом описується інтенсивність розсіювання світла високодисперсною суспензією? Навести математичне вираження цього закону.
58. Яка залежність між довжиною хвилі падаючого світла та інтенсивністю розсіювання його частинками суспензії?
59. Представити математичне вираження залежності інтенсивності розсіяного світла від інтенсивності падаючого світла і концентрації завислих частинок.
60. Які області застосування турбідіметрії і нефелометрії в аналізі?
Розділ 15
Електрохімічні методи аналізу
Електрохімічні методи аналізу ґрунтуються на залежності електричних параметрів (сили струму, напруги, рівноважних електродних потенціалів, електричної провідності, кількості електрики, що пройшла через розчин) від концентрації досліджуваної речовини у розчині.
Кондуктометрія
Кондуктометричний метод аналізу ґрунтується на вимірюванні електричної провідності розчинів у залежності від концентрації електролітів у розчині.
Електрична провідність розчинів електролітів обумовлена рухом йонів під дією зовнішнього джерела напруги. Електропровідність розчину є величиною оберненою електричному опору:
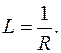
Одиницею електропровідності є обернений Ом – Сименс. 1См = 1Ом–1.
В електричному полі руху йонів заважають молекули розчинника, а також протилежно заряджені йони. Результатом такої гальмуючої дії є опір R розчину електроліту, який на відстані l між електродами з поверхнею S визначається за формулою:
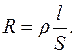
Величина ρ, яка дорівнює опору куба з довжиною ребра 1см, називається питомим опором, а зворотна їй величина називається питомою електропровідністю ϰ:
ϰ= 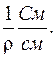
ϰ– електропровідність 1см3 розчину, що знаходиться між електродами площею 1см2, відстань між якими 1см:
ϰ = α·с·F·(Z+·U++Z–·U–),
де α – ступінь дисоціації електроліту;
c – концентрація електроліту, моль/см3;
F – число Фарадея (96500 Кулонів);
U+; U– – рухливості катіонів та аніонів при напрузі електричного поля в 1В/см;
Z+; Z– – заряди катіонів та аніонів.
Питома електропровідність розчину електроліту ϰ збільшується із зростанням концентрації до певної межі, а потім знижується, що обумовлено зменшенням рухливості йонів при збільшенні їх концентрації у розчині.
Більш зручною характеристикою розчину електроліту є його еквівалентна електропровідність λ (См·см2/моль-екв.) – провідність шару електроліту товщиною 1см, що розміщений між електродами такої площі, щоб об’єм електроліту між ними містив 1 моль розчиненої речовини.
Питома та еквівалентна електропровідності зв’язані між собою рівнянням:
λ= ϰ ·1000 ̸ с = ϰ ·V,
де с – концентрація розчину електроліту, моль/см3;
V – об’єм розчину, в якому знаходиться 1 моль речовини, см3;
Ця величина називається розведенням розчину.
Молярна електропровідність розчину електроліту збільшується з розведенням і досягає максимуму при нескінченному розведені, що називається граничною електропровідністю, або електропровідністю при нескінченному розведенні розчину λ∞, яка залежить від природи електроліту і температури та дорівнює сумі граничних молярних електропровідностей катіонів та аніонів:
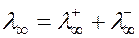 .
.
Із збільшенням концентрацій молярна електропровідність розчину зменшується.
Зменшення еквівалентної електропровідності розчинів сильних електролітів згідно з теорією Дебая-Онзагера пояснюється ефектами електрофоретичного та релаксаційного гальмування. Обидва ефекти пов’язані з наявністю навколо йона йонної атмосфери з йонів протилежного заряду. Електрофоретичний ефект виникає внаслідок того, що центральний йон в електричному полі рухається в одному напрямку, а йонна атмосфера, що має протилежний знак заряду, рухається в протилежному напрямку і гальмує рух йона. Релаксаційне гальмування обумовлено процесами руйнування йонної атмосфери в одному місці та створення нової йонної атмосфери в іншому місці по шляху переміщення в електричному полі йона. За цією теорією залежність еквівалентної електропровідності розчину від концентрації описується рівнянням:
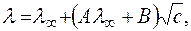
де А – коефіцієнт, що характеризує електрофоретичний ефект;
В – коефіцієнт релаксації.
А і В залежать від температури, в'язкості розчину, діелектричної проникності розчинника і розраховуються теоретично.
Закон адитивності електропровідності розчинів електролітів при нескінченному розведені, що описується рівнянням:
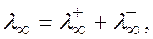
встановлений Ф. Кольраушем і називається законом незалежного руху йонів.
Числові значення рухливості йонів у водному розчині кімнатної температури знаходяться у межах від 30 до 70 См·см2/моль-екв. і лише у йонів H+ і OH– вони є аномальними (λ∞(Н+)=350 См·см2/моль-екв.; λ∞(ОН–) = 199 См·см2/моль-екв.), що пов’язано з особливим механізмом переміщення цих йонів в електричному полі за участі у цьому процесі молекул води. У неводних розчинах рухливість йонів H+ і OH– не відрізняється від рухливості інших йонів.
На електропровідність розчинів слабких електролітів у залежності від їх концентрації впливають не тільки електрофоретичний та релаксаційні ефекти, як це має місце в розчинах сильних електролітів, але і збільшення з розведенням розчину дисоціації слабкого електроліту, що призводить у розведених розчинах до більш швидкого, ніж в розчинах сильних електролітів, підвищення електропровідності. Ця особливість використовується інколи для визначення констант дисоціації слабких електролітів за значеннями електропровідності їх розчинів.
Якщо розчин знаходиться в електричному полі високої частоти (порядку декількох десятків мегагерц), то при цьому проявляються ефекти молекулярної або деформаційної та орієнтаційної поляризації.
Під дією електричного поля електрони будь-якої молекули будуть відтягуватися в бік позитивно зарядженого електрода, а ядра – в бік негативно зарядженого. Це явище називається молекулярною або деформаційною поляризацією. Полярні молекули в електричному полі проявляють також орієнтаційну поляризацію, яка полягає в тому, що дипольні молекули орієнтуються вздовж поля. Поляризація обох типів викликає короткочасний електричний струм, який називається струмом зміщення. Крім того, поляризація молекул призводить до суттєвої зміни діелектричної і магнітної проникності розчину.
Кондуктометричні методи аналізу бувають декількох видів.
Пряма кондуктометрія базується на вимірюванні питомої електропровідності ϰ розчинів електролітів у спеціальних кондуктометричних комірках, у яких є два платинових електрода. Для визначення вмісту солей у водних розчинах, природних водах використовують також кондуктометричні комірки наливного типу з графітовими електродами. У певних межах концентрацій розчинів спостерігається прямо пропорційна залежність між ϰ і концентрацією електролітів. У прямій кондуктометрії вимірювання проводяться з використанням змінного струму з частотою 50-10000 Гц, що дозволяє уникнути поляризації електродів при вимірюванні.
Низькочастотне кондуктометричне титрування застосовується для визначення точки еквівалентності у процесі титрування за різкою зміною електропровідності розчину під час його титрування. У кондуктометричному титруванні застосовують реакції нейтралізації, комплексоутворення, окиснення-відновлення, осадження.
Точку еквівалентності визначають за перетином ділянок графіка титрування у координатах: ϰ–V(титранту). Для отримання достовірних результатів кондуктометричного титрування слід враховувати залежність питомої електропровідності ϰ від констант дисоціації всіх компонентів хімічної реакції, константи дисоціації розчинника, рухливості йонів, йонної сили розчину та ін.
Перевагами низькочастотного кондуктометричного титрування є:
§ можливість диференційованого титрування суміші кислот або основ;
§ титрування непрозорих або забарвлених розчинів;
§ титрування солей, які слабко гідролізуються;
§ висока чутливість (10–4моль/дм3);
§ достатньо висока точність аналізу (відносна похибка титрування порядку ±2%).
Високочастотне кондуктометричне титрування засноване на вимірюванні високочастотної електропровідності розчину у процесі його титрування. Це варіант безконтактного кондуктометричного титрування, при якому досліджуваний розчин піддають дії електричного поля високої частоти (від 1мГц до 100мГц). При підвищенні частоти зовнішнього електричного поля електропровідність розчинів електролітів збільшується (ефект Дебая-Фалькенгагена), оскільки зменшується амплітуда коливання йонів у полі змінного струму. Поле високої частоти викликає деформаційну і орієнтаційну поляризацію молекул, в результаті чого виникають короткочасні струми, що змінюють електропровідність, діелектричні властивості та магнітну проникність розчину. Таким чином, високочастотне титрування має більшу чутливість, ніж низькочастотне.
Точку еквівалентності знаходять за перетином прямолінійних ділянок графіка титрування. Форма графіка високочастотного кондуктометричного титрування залежить від частоти накладеного електричного поля, концентрацій досліджуваного розчину електроліту та титранту, типу електролітичної комірки.
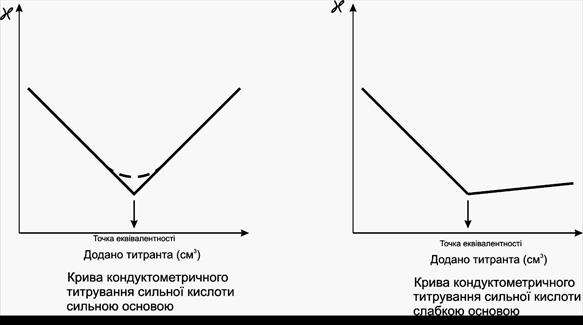
Метод дозволяє проводити визначення до концентрацій 10‑5моль/дм3, відносна похибка ±2%.
Перевагою є те, що електроди не контактують з досліджуваним розчином. Вони розташовані на зовнішній стороні скляної кондуктометричної комірки, тому електроди не поляризуються, не взаємодіють хімічно з компонентами розчину, можуть бути виготовлені з будь-якого металу. За цим методом можна аналізувати агресивні розчини, пасти, емульсії.
Дата добавления: 2020-10-14; просмотров: 1107;











