Абсорбційні оптичні методи аналізу
Ці методи базуються на використанні об’єднаного закону світлопоглинання Бугера-Ламберта-Бера:
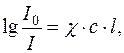
де I0 – інтенсивність світла, що падає на розчин речовини;
I – інтенсивність світла, що пройшло через розчин речовини;
χ – показник поглинання розчину;
c – концентрація досліджуваного розчину;
l – товщина шару розчину;
Величина 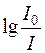 називається оптичною густиною і позначається літерою D.
називається оптичною густиною і позначається літерою D.
Показник поглинання χ – константа для кожної речовини при певній довжині хвилі світла. Вона дорівнює оптичній густині розчину з товщиною шару в 1см і концентрацією в 1моль/дм3. Якщо концентрацію виражають в моль/дм3, тоді χ позначають через ε і називають молярним коефіцієнтом екстинкції. Отже:
D = ε·c·l.
Молярний коефіцієнт поглинання ε характеризує внутрішні властивості речовини і не залежать від об’єму розчину, товщини шару та інтенсивності освітлення. Тому величина ε – найбільш важлива та об’єктивна характеристика можливої чутливості фотометричного визначення. Значення ε в області максимуму для різних поглинаючих світло речовин дуже відрізняється. Так, смуги поглинання йонів Cu2+, Ni2+ та інших у видимій частині спектра мають низькі значення ε порядка 10-100. Забарвлені амоніакати, пероксидні та інші одноріднолігандні комплекси мають значення ε≈102-103. Багато комплексів з органічними реактивами (наприклад, алізаринати, дітізонати та ін.) мають дуже високі значення ε – порядка 104-105.
Оптична густина розчину, що містить декілька забарвлених речовин, має властивість адитивності. У присутності в розчині декількох забарвлених речовин, кожна з них буде давати свій адитивний внесок в оптичну густину D:
D = D1+D2+…+Dn.
Світло поглинається розчином вибірково: при деяких довжинах хвиль поглинання світла відбувається інтенсивно, а при інших світло не поглинається. Інтенсивно поглинаються кванти світла, енергія яких hν дорівнює енергії збудження частинки і вірогідність її поглинання більша за нуль. Молярний коефіцієнт поглинання при цих довжинах хвиль має високе значення.
Розподілення за частотами або зо довжинами хвиль значень молярного коефіцієнта поглинання називається спектром поглинання.
Переважно спектр поглинання виражають у вигляді графічної залежності оптичної густини D або молярного коефіцієнта поглинання ε від частоти ν або довжини хвилі λ падаючого світла. Замість D або ε часто відкладають на графіку їх логарифми.
Повне підпорядкування закону Бугера-Ламберта-Бера виконується тільки при монохроматичному випромінюванні, яке має місце у спектрофотометрії. При використанні немонохроматичного випромінювання, що має місце у фотоколориметрії, цей закон має наближене значення, що пов’язане із постійністю величини коефіцієнта світлопоглинання у певному інтервалі довжини хвиль, які отримують за допомогою світлофільтрів. Вони дозволяють виділити порівняно вузький інтервал довжин хвиль в області зони поглинання досліджуваної речовини. При цьому найменші помилки будуть відчутні для речовини з широкою смугою поглинання.
Крім того, закон Бугера-Ламберта-Бера справедливий лише у тому випадку, коли із зміною концентрації речовини вона не зазнає хімічних змін: не відбувається асоціація молекул при високій концентрації речовини, а також речовина не дисоціює на йони. Цей закон без обмежень можна застосовувати тільки для розведених розчинів, для концентрацій речовин менше 0,01моль/дм3. При більших концентраціях частинки, що поглинають світло, настільки близько розташовані одна біля одної, що кожна частинка впливає на розподілення заряду сусідніх частинок, що призводить до зміни здатності частинок поглинати світло даної довжини хвилі. У цьому випадку спостерігається відхилення від прямолінійної залежності інтенсивності поглинання світла від концентрації речовини в розчині.
Похибки вимірювання можуть виникати також через те, що при проходженні через межу повітря – скло близько 4 % світлового потоку відбивається. Цю похибку можна звести до мінімуму, якщо порівнювати світлові потоки, які проходять крізь кювети з досліджуваним та стандартним (або холостим) розчинами.
Хімічні причини відхилень від закону Бугера-Ламберта-Бера пов’язані з дисоціацією та асоціацією хімічних сполук, впливом інших речовин, присутніх у розчині, а також з іншими хімічними процесами, що відбуваються у розчинах з утворенням гідроксокомплексів, взаємодією з розчинником з утворенням кислих солей, зміною складу комплексних сполук у зв’язку із ступінчастим характером їх утворення та ін.
Фотоколориметрія
Метод ґрунтується на вимірюванні поглинання немонохроматичного світла, яке проходить крізь забарвлений досліджуваний розчин. Немонохроматичне випромінювання з вузьким діапазоном довжин хвиль одержують за допомогою світлофільтрів. Інтенсивність світла, що пройшло крізь досліджуваний розчин, вимірюється за величиною електричного струму, який виникає у фотоелементі. Шкала індикатора градуйована у величинах оптичної густини D та у величинах коефіцієнта світлопропускання T. Величина T дорівнює відношенню 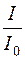 .
.
Відносна похибка фотоколориметричних вимірювань не перевищує 3 %.
При визначенні у розчині однієї світлопоглинаючої речовини аналітичну довжину хвилі, як правило, вибирають на максимумі смуги поглинання. Якщо в спектрі є декілька смуг, вибирають найбільш інтенсивну, оскільки робота в області максимуму світлопоглинання забезпечує найбільш високу чутливість визначення. Бажано також, щоб і чутливість приймача випромінювання в області аналітичної довжини хвилі була максимальною. Світлофільтри вибирають таким чином, щоб максимум поглинання світла розчином відповідав мінімуму поглинання світлофільтра. Вибір аналітичної довжини хвилі за наявності у розчині декількох світлопоглинаючих речовин є складнішим.
|
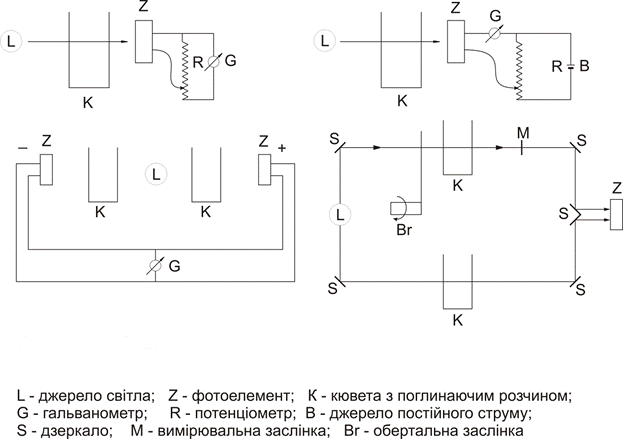
Мінімальна помилка визначення на фотоелектроколориметрі буде тоді, коли оптична густина розчину знаходиться в інтервалі 0,2-0,7.
З рівняння закону Бугера-Ламберта-Бера видно, що чим більша товщина шару розчину, тим більша оптична густина і, отже, тим більш чутливим буде визначення. Проте, із збільшенням товщини шару (довжина оптичного шляху) зростають втрати на розсіювання світла. Кювети з товщиною шару більшою за 5см для фотометрії розчинів не застосовуються.
Спектрофотометрія
Спектрофотометрія відрізняється від фотоколориметрії тим, що аналіз здійснюють за поглинанням речовинами монохроматичного випромінювання в ультрафіолетовій, видимій та інфрачервоній областях спектра.
Аналіз речовин проводиться або за відомими параметрами спектра поглинання досліджуваної речовини, або за порівнянням спектрів поглинанням розчину стандартної речовини і розчину досліджуваної речовини одного і того ж складу, які одержані в однакових умовах.
Спектрофотометричні визначення ґрунтуються на законі Бугера-Ламберта-Бера, але, на відміну від фотоколориметричних досліджень, можна аналізувати не лише забарвлені, а й безбарвні розчини, проводячи в останньому випадку вимірювання в ультрафіолетовій чи інфрачервоній областях спектра.
Спектрофотометрія має ряд переваг над фотоколориметрією:
§ одночасне кількісне визначення декількох компонентів багатокомпонентних сумішей, оскільки кожен компонент має максимум поглинання при певній довжині хвилі;
§ визначення складу та констант нестійкості комплексних сполук;
§ визначення констант йонізації кислот, основ та ін.,
Спектрофотометри забезпечують монохроматичне випромінювання не за допомогою світлофільтрів, як у фотоколориметрії, а за допомогою спеціальних оптичних пристроїв – монохроматорів, які дозволяють безперервно змінювати довжину хвилі випромінювання, яке проходить через розчин досліджуваної речовини.
У спектрофотометричному аналізі, як і у фотоколориметрії, необхідно створювати оптимальні умови для досягнення певної точності та відтворюваності результатів. Відносна похибка спектрофотометричних визначень індивідуальних речовин не перевищує 2%.
При вимірюванні в ультрафіолетовій області та видимій частині спектра придатні розчинники, які не містять домішок, що поглинають у даній спектральній області. Як розчинники використовують воду, спирти, хлороформ, розчини кислот та лугів.
Концентрацію розчину та товщину шару розчину, через який проходить світло, підбирають таким чином, щоб значення оптичної густини знаходилося у межах 0,2-0,7, що забезпечує мінімальну похибку вимірювань.
Для перевірки правильності показників спектрофотометрів, готують розчин калій дихромату, що містить 60,06мг K2Cr2O7 в 1дм3 розчину сульфатної кислоти, с=0,005моль/дм3. Величини оптичних густин для зазначеного розчину при різних довжинах хвиль мають бути такими:
| λ=235 нм | D=0,748 |
| λ=257 нм | D=0,845 |
| λ=313 нм | D=0,292 |
| λ=350 нм | D=0,640 |
Основним методом визначення концентрацій розчинів є порівняння оптичних густин стандартного та досліджуваного розчинів:
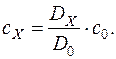
Іншим методом визначення концентрації розчину є використання калібрувального графіка. Готують серію стандартних розчинів досліджуваної речовини, визначають їх оптичні густини та будують графік у системі С–D. Вимірюють оптичну густину досліджуваного розчину та визначають його концентрацію за калібрувальним графіком.
Крім того, концентрацію розчину можна визначити за середнім значенням молярного коефіцієнта поглинання за формулою:
D = ε·c; 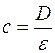 ;
;
При високих концентраціях розчинів, коли оптична густина стає більшою за одиницю, різко зростає похибка як фотоколориметричних, так і спектрофотометричних вимірювань.
Дата добавления: 2020-10-14; просмотров: 1042;











