Приклади розв’язування задач
Приклад 1. Визначити еквівалент і фактор еквівалентності фосфатної (V) кислоти у реакції з розчином натрій гідроксиду:
H3PO4 + 3NaOH = Na3PO4 + 3H2O.
Розв’язування
Один гідроксид-іон еквівалентний одному гідроген-іону. Фактор еквівалентності визначається з того, що 3моль NaOH реагують з 1моль H3PO4. Отже, еквівалент H3PO4 становить 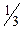 частину моля H3PO4, фактор еквівалентності дорівнює
частину моля H3PO4, фактор еквівалентності дорівнює 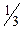 :
:
ƒекв(H3PO4)= 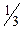 .
.
У іншій реакції (H3PO4 + 2NaOH = Na2НPO4 + 2H2O) 2моль NaOH реагують з 1моль H3PO4, що відповідає 2моль гідроген-іонів. Отже, еквівалент H3PO4 у цій реакції становить ½ частку моль H3PO4. Фактор еквівалентності дорівнює ½ :
ƒекв(H3PO4)=½.
Приклад 2. Визначити еквівалент і фактор еквівалентності K2Cr2O7 у реакції:
K2Cr2O7 + 6КI + 7H2SO4 = Cr2(SO4)3 + 4K2SO4 +3I2 + 7H2O.
Розв’язування
Це реакція окиснення-відновлення. Еквівалент визначається кількістю електронів, що приєднує чи віддає частинка в реакції:
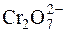 + 6ē + 14Н+ = 2Cr3+ + 7H2O.
+ 6ē + 14Н+ = 2Cr3+ + 7H2O.
Один йон 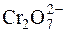 приєднує 6 електронів. Отже, еквівалент K2Cr2O7 у цій реакції становить
приєднує 6 електронів. Отже, еквівалент K2Cr2O7 у цій реакції становить 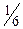 частку моля K2Cr2O7, а фактор еквівалентності дорівнює
частку моля K2Cr2O7, а фактор еквівалентності дорівнює 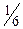 :
:
ƒекв(K2Cr2O7)= 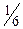 .
.
Приклад 3. На титрування розчину щавлевої кислоти розчином натрій гідроксиду з молярною концентрацією NaOH 0,1235моль/дм3 було витрачено 13,50см3 розчину NaOH. Речовини реагували між собою згідно з рівнянням реакції:
H2С2O4 + 2NaOH = Na2С2O4 + 2H2O.
Знайти вміст щавлевої кислоти у розчині.
Дано:
c(NaOH)=0,1235моль/дм3 М(H2С2O4)=90г/моль
 V(NaOH(р))=13,50см3
V(NaOH(р))=13,50см3
m(H2С2O4) – ?
Розв’язування
У даній реакції фактор еквівалентності H2С2O4 дорівнює ½
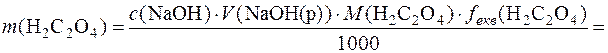
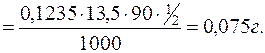
Приклад 4. Розрахувати масу натрій гідроксиду, що міститься у 500,00см3 розчину якщо на титрування 20,00см3 цього розчину треба затратити 20,80см3 розчину хлоридної кислоти, титр якого дорівнює 0,002022г/см3.
Дано:
V1(NaOH(р))=500,00см3 M(  NaOH)=39,99г/моль
NaOH)=39,99г/моль
V2(NaOH(р))=20,00см3 M(  HCl)=36,46г/моль
HCl)=36,46г/моль
V(HCl(р))=20,80см3
Т(HCl)=0,002022г/см3
 m(NaOH) – ?
m(NaOH) – ?
Розв’язування
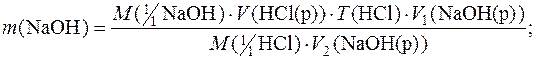
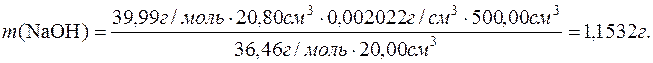
Приклад 5. Розрахувати масу оцтової кислоти, що знаходиться у розчині об’ємом 500,00см3, ящо на титрування 25,00см3 цього розчину витрачається 20,50см3 розчину натрій гідроксиду з молярною концентрацією еквівалента речовини NaOH 0,1145моль/дм3.
Дано:
V1(CH3COOH(р))=500,00см3 М(  CH3COOH)=60,05г/моль
CH3COOH)=60,05г/моль
V2(CH3COOH(р))=25,00см3 М(  NaOH)=39,99г/моль
NaOH)=39,99г/моль
V(NaOH(р))=20,50см3
 c(
c(  NaOH)=0,1145моль/дм3
NaOH)=0,1145моль/дм3
m(CH3COOH) – ?
Розв’язування
Знаходять титр розчину NaOH з молярною концентрацією еквівалента речовини NaOH 0,1145моль/дм3 за оцтовою кислотою:

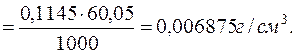
Далі визначається маса оцтової кислоти у загальному об’ємі розчину:
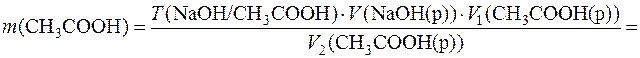
= 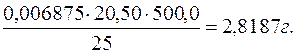
Приклад 6. Титр розчину арґентум нітрату дорівнює 0,01702г/см3. Визначити титр цього розчину за натрій хлоридом та молярну концентрацію еквівалента розчину AgNO3.
Дано:
 Т(AgNO3)=0,01702г/см3 М(
Т(AgNO3)=0,01702г/см3 М(  AgNO3)=169,9г/моль
AgNO3)=169,9г/моль
с(  AgNO3) – ? М(
AgNO3) – ? М(  NaСl)=58,46г/моль
NaСl)=58,46г/моль
Т(AgNO3/NaСl) – ?
Розв’язування
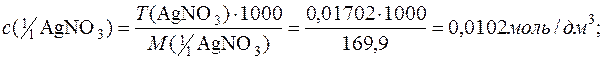
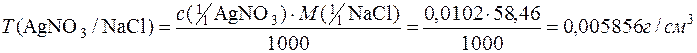
Приклад 7. На титрування суміші натрій карбонату і калій карбонату загальною масою 0,4000г було використано 22,00см3 розчину хлоридної кислоти з молярною концентрацією еквівалента речовини НСl 0,3000моль/дм3. Розрахувати масові частки (%) Na2СO3 і К2СO3 у суміші.
Дано:
m(Na2СO3)+m(К2СO3)=0,4000г М(1/2Na2СO3)=52,994г/моль
V(НСl(р))=22,00см3 М(1/2К2СO)=69,103г/моль
 с(
с(  НСl)=0,3000моль/дм3
НСl)=0,3000моль/дм3
w(Na2СO3) – ?
w(К2СO3) – ?
Розв’язування
Якщо w – масова частка (%) Na2СO3 у суміші, то кількості речовини еквівалентів Na2СO3 і К2СO3, що містяться у даній масі суміші, будуть:
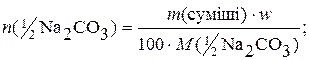
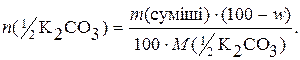
У точці еквівалентності
n(½Na2СO3) + n(½К2СO3) = n(НСl),
де 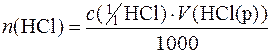 – кількість речовини НСl, яка була витрачена на титрування.
– кількість речовини НСl, яка була витрачена на титрування.
Тоді:
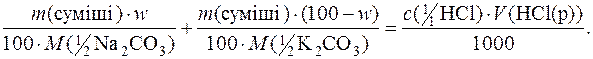
Підставляючи числові значення, маємо:
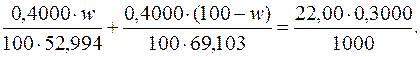
Звідси: w=46,12.
Отже, масова частка Na2СO3 у досліджуваній суміші становить 46,12%, а масова частка К2СO3 – (100–46,12)=53,88%.
Приклад 8. Проводячи аналіз стічної води, до проби цієї води об’ємом 100,0см3 додали при нагріванні 25,00см3 розчину барій хлориду з молярною концентрацією речовини ВаCl2 0,02моль/дм3 (K=0,9816). Надлишок ВаCl2 відтитрували у присутності амоніачного буферу, що містив магній комплексонат і еріохром чорний Т, витративши при цьому 17,00см3 розчину ЕДТА з молярною концентрацією ЕДТА 0,02моль/дм3 (K=1,018). Розрахувати концентрацію йонів 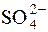 у стічній воді в г/дм3.
у стічній воді в г/дм3.
(K – поправочний коефіцієнт до концентрацій).
Дано:
V(стічної води)=100,0см3 М( 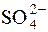 )=96,06г/моль
)=96,06г/моль
V(ВаCl2(р))=25,00см3
с(ВаCl2)=0,02моль/дм3
K1(ВаCl2(р))=0,9816
V(ЕДТА(р))=17,00см3
с(ЕДТА)=0,02моль/дм3
K2(ЕДТА(р))=1,018
 с(
с( 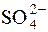 ) в г/дм3 – ?
) в г/дм3 – ?
Розв’язування
У точці еквівалентності справедливе співвідношення:
n( 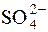 ) = n(ВаCl2) – n(ЕДТА).
) = n(ВаCl2) – n(ЕДТА).
Якщо позначити концентрацію йонів 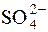 у стічній воді через х г/дм3, тоді:
у стічній воді через х г/дм3, тоді:
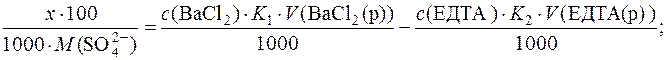
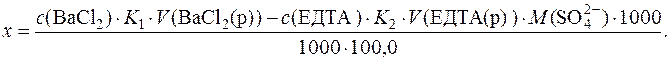
Підставляючи числові значення, отримуємо:
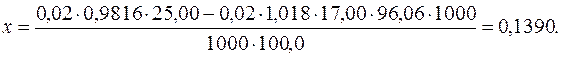
Отже, концентрація йонів 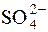 у стічній воді становить 0,1390г/дм3.
у стічній воді становить 0,1390г/дм3.
Приклад 9. У мірній колбі об’ємом 500,00см3 розчинили 5,360г технічного калій хлориду. До 25,00см3 отриманого розчину додали 50,00см3 розчину аргентум нітрату з молярною концентрацією речовини AgNO3 0,1моль/дм3 (K=0,8470). На титрування надлишку AgNO3 витрачається 23,88см3 розчину амоній тіоціанату (Т(NH4SCN/Ag+)=0,01063г/см3). Розрахувати масову частку (%) КCl у зразку.
Дано:
V1(КCl(р))=500,0см3 М(КCl)=74,55г/моль
V2(КCl(р))=25,00см3 М(Ag+)=107,878г/моль
m(КCl)=5,360г
V(AgNO3(р))=50,00см3
с(AgNO3)=0,1моль/дм3
K=0,8470
V(NH4SCN(р))=23,88см3
Т(NH4SCN/Ag+)=0,01063г/см3.
 w(КCl) – ?
w(КCl) – ?
Розв’язування
Кількість речовини КCl визначається із співвідношення:
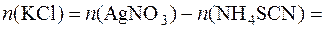
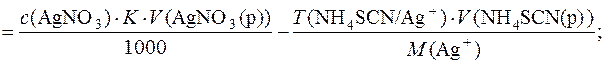
Масову частку (%) КCl у зразку визначають за формулою:
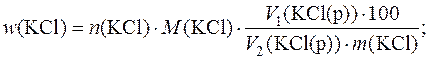
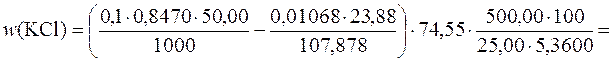
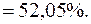
Приклад 10. Чому дорівнює індикаторна похибка титрування розчину хлоридної кислоти (с(  НСl)=0,1моль/дм3) розчином натрій гідроксиду (с(
НСl)=0,1моль/дм3) розчином натрій гідроксиду (с(  NaOH)=0,1моль/дм3) з індикатором метиловим червоним (рТ=5)?
NaOH)=0,1моль/дм3) з індикатором метиловим червоним (рТ=5)?
Розв’язування
Оскільки титрування закінчиться при pH=5, то наявність у розчині сильної кислоти, так як розчин недотитрований, викличе Н+-похибку (зі знаком мінус).
Н+-похибка = 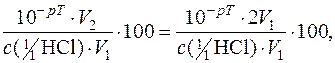
де V1 – об’єм кислоти, яка титрується;
V2 – загальний об’єм розчину в кінці титрування.
Так як у процесі титрування використовувались розчини однакової концентрації, то V2=2V1.
Тоді Н+-похибка = 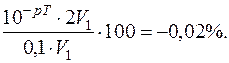
Похибка мала, тому для даного титрування можна застосувати індикатор метиловий червоний.
Приклад 11. Чи можна відтитрувати розчин натрій гідроксиду (с(  NaOH)=0,02моль/дм3) розчином хлоридної кислоти (с(
NaOH)=0,02моль/дм3) розчином хлоридної кислоти (с(  НCl)=0,02моль/дм3): а) з фенолфталеїном (рТ=9); б) з метиловим оранжевим (рТ=4)?
НCl)=0,02моль/дм3): а) з фенолфталеїном (рТ=9); б) з метиловим оранжевим (рТ=4)?
Розв’язування
У першому випадку точка еквівалентності досягається при pH=7. Після закінчення титрування (pH=9) у розчині ще є невідтитрований луг, що викличе ОН–-похибку.
ОН–-похибка = 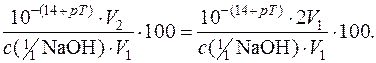
ОН–-похибка = 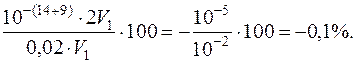
Похибка незначна, отже фенолфталеїн цілком придатний для визначення кінця титрування у даному випадку.
У другому випадку титрування закінчується за наявності у розчині надлишку сильної кислоти (pH=4), тобто буде мати місце Н+-похибка зі знаком плюс, так як розчин перетитрований:
Н+-похибка = 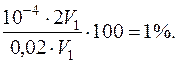
Через велику похибку індикатор метиловий оранжевий у даному випадку титрування застосувати не можна.
Приклад 12. Мідний купорос CuSO4·5H2O масою 6,2508г розчинили у мірній колбі на 250см3 і довели водою до риски. До 25,00см3 отриманого розчину додали надлишок КІ. На титрування йоду, що виділився, було витрачено 24,1см3 розчину натрій тіосульфату з молярною концентрацією еквівалента Na2S2O3 0,1015моль/дм3. Розрахувати масову частку йонів Cu2+ у мідному купоросі.
Дано:
m(CuSO4)=6,2508г M(Cu2+)=63,54г/моль
V1(CuSO4(p))=250см3
V2(CuSO4(p))=25,00см3
V(Na2S2O3(p))=24,1см3
с(½Na2S2O3)=0,1015моль/дм3
 w(Cu2+) – ?
w(Cu2+) – ?
Розв’язування
Визначають молярну концентрацію еквівалента речовини CuSО4 у розчині:
Ошибка! Ошибка связи.
= 0,09783моль/дм3
Визначають масу йонів Cu2+ у загальному об’ємі отриманого розчину:
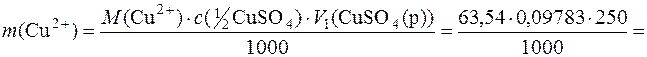
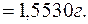
Визначають масову частку йонів Сu2+ у мідному купоросі:
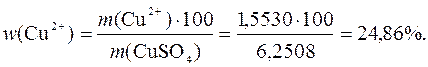
Контрольні задачі
1. Яка молярна концентрація еквівалентна розчину сульфатної кислоти, титр якого становить 0,02446г/см3? (ƒекв(H2SO4)=½).
Відповідь: 0,4988моль/дм3.
2. Яка молярна концентрація еквівалентна розчину хлоридної кислоти, якщо Т(КCl/КОН)=0,01353г/см3?
Відповідь: 0,2501моль/дм3.
3. Яка молярна концентрація еквівалентна розчину натрій гідроксиду, якщо Т(NaOH/SO3)=0,02174г/см3?
Відповідь: 0,5431моль/дм3.
4. Молярна концентрація еквівалентна розчину сульфатної кислоти становить 0,1008моль/дм3 (ƒекв(H2SO4)=½). Розрахувати титр цього розчину.
Відповідь: 0,004943г/см3.
5. Розрахувати Т(КОН/SO3), якщо молярна концентрація еквівалента речовини КОН у цьому розчині становить 0,1021моль/дм3.
Відповідь: 0,004087г/см3.
6. У розчині об’ємом 500см3 міститься 2,6578г Na2CO3. Розрахувати молярну концентрацію еквівалента і титр цього розчину при взаємодії Na2CO3 з HCl до СО2.
Відповідь: 0,1003моль/дм3; 0,005316г/см3.
7. У розчині об’ємом 1500см3 міститься 28,00г КОН і 40,20г NaOH. Яка молярна концентрація еквівалента цього розчину?
Відповідь: 1,0030моль/дм3.
8. До розчину хлоридної кислоти об’ємом 550см3 (с(  НCl)=0,1925моль/дм3) додали розчин хлоридної кислоти об’ємом 50см3, титр якого становить 0,02370г/см3. Яка молярна концентрація еквівалента і титр отриманого розчину?
НCl)=0,1925моль/дм3) додали розчин хлоридної кислоти об’ємом 50см3, титр якого становить 0,02370г/см3. Яка молярна концентрація еквівалента і титр отриманого розчину?
Відповідь: 0,2306моль/дм3; 0,008408г/см3.
9. Який об’єм води треба додати до 1дм3 розчину хлоридної кислоти (с(  НCl)=0,5300моль/дм3), щоб отримати розчин з молярною концентрацією еквівалента речовини НCl 0,5000моль/дм3?
НCl)=0,5300моль/дм3), щоб отримати розчин з молярною концентрацією еквівалента речовини НCl 0,5000моль/дм3?
Відповідь: 60см3.
10. Який об’єм хлоридної кислоти (d=1,19г/см3) треба взяти для приготування розчину об’ємом 1дм3 з молярною концентрацією еквівалента речовини НCl 0,1000моль/дм3?
Відповідь: 8см3.
11. Який об’єм сульфатної кислоти (d=1,835г/см3) треба взяти для приготування розчину об’ємом 2,5дм3 з молярною концентрацією еквівалента речовини H2SO4 0,2000моль/дм3? (ƒекв(H2SO4)=½).
Відповідь: 27,9см3.
12. Для приготування розчину хлоридної кислоти об’ємом 500см3 було взято 20,00см3 розчину хлоридної кислоти (d=1,19г/см3). Яка молярна концентрація еквівалента отриманого розчину?
Відповідь: 0,5000моль/дм3.
13. Розрахувати молярну концентрацію еквівалента розчину хлоридної кислоти і титр цього розчину, якщо на титрування 0,4217г бури Na2B4O7·10H2O було витрачено 17,50см3 розчину кислоти.
Відповідь: 0,1234моль/дм3.
14. Розрахувати молярну концентрацію еквівалента розчину H2SO4, якщо до 10см3 цього розчину додали надлишок ВаCl2. Маса отриманого осаду після фільтрування, прожарювання і зважування становила 0,2762г.
Відповідь: 0,1188моль/дм3.
15. Оксалатну кислоту Н2С2О4·2Н2О масою 0,600г розчинили у воді і довели об’єм розчину до 100,0см3. На титрування 20,00см3 отриманого розчину було використано 18,34см3 розчину NaOH. Визначити молярну концентрацію еквівалента розчину натрій гідроксиду і Т(NaOH/H2C2O4).
Відповідь: 0,1039моль/дм3; 0,004677г/см3.
16. До якого об’єму треба довести розчин, що містить 1,5300г NaOH, водою, щоб на титрування 20,00см3 розчину використати 14,70см3 розчину хлоридної, титр якого становить 0,003800г/см3?
Відповідь. 500,0см3.
17. Яка маса Na2CO3 міститься у розчині, якщо на нейтралізацію до NaHCO3 пішло 21,40см3 розчину хлоридної кислоти, титр якого становить 0,002789г/см3?
Відповідь: 0,1735г.
18. На титрування розчину, у якому розчинено 0,1370г щавлевої кислоти, було використано 22,10см3 розчину натрій гідроксиду (с(  NaOH)=0,0984моль/дм3). Скільки молекул кристалізаційної води містить кислота?
NaOH)=0,0984моль/дм3). Скільки молекул кристалізаційної води містить кислота?
Відповідь: 2.
19. Технічну буру масою 2,0712г розчинили у мірній колбі і довели об’єм водою до 100,0см3. На титрування 20,00см3 отриманого розчину пішло 21,80см3 розчину хлоридної кислоти (Т(НCl/NaOH)=0,003974г/см3). Визначити масову частку Na2B4O7·10H2O у технічній бурі.
Відповідь: 99,71%.
20. На титрування розчину, що містить 3,1580г технічного КОН, використано 27,45см3 розчину НCl (Т(HCl/NaOH)=0,07862г/см3). Визначити масову частку КОН у зразку.
Відповідь: 95,87%.
21. На нейтралізацію 0,2000г суміші хімічно чистих натрій карбонату і калій карбонату було витрачено 11,00см3 розчину кислоти (с(  кислоти)=0,3000моль/дм3). Розрахувати масові частки Na2CO3 i K2CO3 у суміші.
кислоти)=0,3000моль/дм3). Розрахувати масові частки Na2CO3 i K2CO3 у суміші.
Відповідь: 46,16% Na2CO3; 53,84% К2CO3.
22. Технічний натрій гідроксид масою 0,3251г розчинили у воді в мірній колбі на 100,0см3 і довели об’єм водою до риски. На титрування отриманого розчину об’ємом 25,00см3 було витрачено 20,00см3 розчину хлоридної кислоти (с(  НCl)=0,4455моль/дм3). Визначити масову частку NaOH у технічному зразку.
НCl)=0,4455моль/дм3). Визначити масову частку NaOH у технічному зразку.
Відповідь: 88,59%.
23. На титрування з фенолфлатеїном наважки 0,4478г суміші Na2CO3, NaHCO3 i NaCl пішло 18,80см3 розчину кислоти з молярною концентрацією еквівалента 0,1998моль/дм3. На титрування з метиловим оранжевим на ту ж наважку пішло 40,00см3 кислоти. Визначити масові частки компонентів суміші.
Відповідь: 88,91% Na2CO3; 9,00% NaHCO3; 2,09%NaCl.
24. Технічний натрій гідроксид масою 0,4000г розчинили у мірній колбі на 100,0см3 і довели об’єм водою до риски. На титрування 20,00см3 отриманого розчину з метиловим оранжевим використали 19,20см3 розчину хлоридної кислоти (Т(НCl)=0,003600г/см3). Таку ж пробу розчину обробили розчином ВаCl2 з молярною концентрацією еквівалента ВаCl2 2,0000моль/дм3 до повного осадження карбонатів і при титруванні з фенолфлатеїном використали 18,80см3 розчину хлоридної кислоти. Визначити масову частку карбонатних домішок у препараті.
Відповідь: 2,62%.
25. Визначити тимчасову жорсткість води, якщо на титрування з метиловим оранжевим 200,0см3 досліджуваної води використали 10,00см3 розчину НCl, титр якого становить 0,001760г/см3.
Відповідь: 2,4ммоль/дм3.
26. До суміші SrCO3 i Li2CO3 загальною масою 0,4789г додали 40,00см3 розчину хлоридної кислоти (с(  НCl)=0,5100моль/дм3). Надлишок кислоти відтитрували розчином натрій гідроксиду. На титрування пішло 20,00см3 NaOH (Т(NaOH/HCl)=0,018525г/см3). Які масові частки SrCO3 i Li2CO3 у суміші?
НCl)=0,5100моль/дм3). Надлишок кислоти відтитрували розчином натрій гідроксиду. На титрування пішло 20,00см3 NaOH (Т(NaOH/HCl)=0,018525г/см3). Які масові частки SrCO3 i Li2CO3 у суміші?
Відповідь: 40,15% SrCO3; 59,85% Li2CO3.
27. До суміші Na2CO3 i NaHCO3 масою 0,5000г додали 25,00см3 розчину хлоридної кислоти, титр якого становить 0,004000г/см3. На титрування надлишку кислоти витрачено 15,00см3 розчину натрій гідроксиду, титр якого дорівнює 0,002000г/см3. Яка масова частка Na2CO3 у суміші?
Відповідь: 66,52% .
28. Суміш хімічно чистих NaH2PO4 i Na2HPO4 загальною масою 4,8215г розчинили в 200,0см3 розчину хлоридної кислоти (с(  НCl)=0,1982моль/дм3). На титрування 20,00см3 отриманого розчину з фенолфлатеїном витрачено 21,00см3 розчину натрій гідроксиду, титр якого становить 0,002000г/см3. Визначити масову частку Na2HPO4 у суміші.
НCl)=0,1982моль/дм3). На титрування 20,00см3 отриманого розчину з фенолфлатеїном витрачено 21,00см3 розчину натрій гідроксиду, титр якого становить 0,002000г/см3. Визначити масову частку Na2HPO4 у суміші.
Відповідь: 27,47%.
29. До кристалічного Na3PO4 масою 0,1000г додали 25,00см3 розчину сульфатної кислоти (с(½H2SO4)=0,2моль/дм3). На зворотне титрування залишку кислоти з метиловим оранжевим витратили 15,00см3 розчину натрій гідроксиду. Яка молярна концентрація еквівалента розчину NaOH?
Відповідь: 0,5850моль/дм3.
30. Анілін масою 0,0327г розчинили у 50,00см3 безводної оцтової кислоти і відтитрували розчином НClО4 у безводній оцтовій кислоті (с(  НClО4)=0,1000моль/дм3) з кристалічним фіолетовим. Який об’єм титранту пішов на тирування?
НClО4)=0,1000моль/дм3) з кристалічним фіолетовим. Який об’єм титранту пішов на тирування?
Відповідь: 35,2см3.
31. Яка молярна концентрація еквівалента розчину натрій хлориду, якщо на титрування 20,00см3 цього розчину витрачається 18,62см3 розчину Hg(NO3)2 (с(½Hg(NO3)2)=0,1000моль/дм3)?
Відповідь: 0,0931моль/дм3
32. На титрування розчину NaCl, що містить 0,1050г натрій хлориду, використано 20,00см3 розчину Hg2(NO3)2. Яка молярна концентрація еквівалента розчину Hg2(NO3)2?
Відповідь: 0,08983моль/дм3.
33. На титрування розчину, отриманого розчиненням 0,2082г NaBr, використано 22,80см3 розчину Hg2(NO3)2. На титрування 20,0см3 Hg2(NO3)2 витрачено 19,82см3 розчину NH4SCN. Визначити молярну концентрацію еквівалента і титр розчину NH4SCN.
Відповідь: 0,08954моль/дм3; 0,006816г/см3
34. Розрахувати молярну концентрацію еквівалента і титр розчину трилону Б, якщо на титрування 25,00см3 цього розчину використано 24,45см3 розчину ZnSO4 (c(ZnSO4)=0,1100моль/дм3).
Відповідь: 0,1075моль/дм3; 0,02001г/см3
35. Яка маса натрій хлориду міститься в 250,0см3 розчину, якщо на титрування 25,00см3 цього розчину використано 26,45см3 розчину AgNO3 (c(  AgNO3)=0,0500моль/дм3)?
AgNO3)=0,0500моль/дм3)?
Відповідь: 0,7729г.
36. У мірну колбу на 250,0см3 внесли 25,00см3 розведеної хлоридної кислоти і довели водою до риски. На титрування 20,00см3 отриманого розчину використано 24,37см3 розчину AgNO3 (c(  AgNO3)=0,9850моль/дм3). Розрахувати масу HCl, що міститься в 1дм3 досліджуваної кислоти.
AgNO3)=0,9850моль/дм3). Розрахувати масу HCl, що міститься в 1дм3 досліджуваної кислоти.
Відповідь: 437,61г.
37. Який об’єм розчину калій ціаніду, молярна концентрація еквівалента якого становить 0,1056моль/дм3, необхідний для титрування 20,00см3 розчину аргентум нітрату (Т(AgNO3)=0,01126г/см3)?
Відповідь: 12,55см3.
38. Визначити масову частку срібла у сплаві, якщо після розчинення 0,2000г цього сплаву на титрування отриманого розчину використано 39,60см3 розчину, що містить 0,4103 KSCN у 100,0см3. Вважати, що інші компоненти сплаву з йонами SCN– не утворюють малорозчинні осади.
Відповідь: 90,17%.
39. Технічний KBr масою 0,3838г розчинили у воді. На титрування отриманого розчину було використано 23,80см3 розчину AgNO3, T(AgNO3/Cl–)=0,003546г/см3. Визначити масову частку KBr у зразку.
Відповідь: 73,81%.
40. Після відповідної обробки, скло масою 3,0340г перевели у розчин і об’єм розчину довели водою до 100,0см3. На титрування 20,00см3 отриманого розчину було використано 7,06см3 розчину трилону Б (с=0,0050моль/дм3). Визначити масову частку Fe у склі.
Відповідь: 0,32%.
41. На титрування 20,00см3 розчину оксалатної кислоти, титр якого становить 0,006900г/см3, використано 25,00см3 розчину KMnO4. Розрахувати молярну концентрацію еквівалента і титр розчину KMnO4.
Відповідь: 0,08656моль/дм3; 0,002768г/см3.
42. На титрування 25,00см3 розчину FeSO4 в H2SO4 використано 31,25см3 розчину K2Cr2O7 (c(1/6K2Cr2O7)=0,1000моль/дм3). Який об’єм води слід додати до 20,00см3 розчину FeSO4, щоб отримати розчин з молярною концентрацією еквівалента речовини FeSO4 точно 0,0500моль/дм3?
Відповідь: 300,0см3.
43. Розрахувати масову частку H2C2O4·2H2O у технічному препараті щавлевої кислоти, якщо на титрування розчину, отриманого розчиненням 0,2003г технічного препарату кислоти, було витрачено 29,30см3 розчину KMnO4, 1,00см3 якого еквівалентний 0,006023г Fe.
Відповідь: 99,45%.
44. Яка маса Н2О2 міститься у розчині, якщо на його титрування використано 14,50см3 розчину KMnO4, 1,00см3 якого еквівалентний 0,08376г Fe?
Відповідь: 0,03532г.
45. Який об’єм розчину, що містить 25,00г/дм3 K2Cr2O7, еквівалентний 3,4000г FeSO4·7H2O в кислому середовищі?
Відповідь: 23,98см3.
46. Зразок масою 0,1000г, що містить 99,98% заліза, розчинили в розчині сульфатної кислоти без доступу повітря і отриманий розчин відтитрували розчином KMnO4 (c( 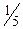 KMnO4)=0,1000моль/дм3). Який об’єм розчину KMnO4 пішов на титрування?
KMnO4)=0,1000моль/дм3). Який об’єм розчину KMnO4 пішов на титрування?
Відповідь: 17,90см3.
47. До розчину, що містить 0,1510г технічного KClO3, додали 100,0см3 розчину Na2C2O4 (c(½Na2C2O4)=0,09852моль/дм3), надлишок якого відтитрували розчином KMnO4 (c( 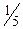 KMnO4)=0,0532моль/дм3). На титрування було витрачено 48,60см3 розчину калій перманганату. Розрахувати масову частку КClО3 у зразку.
KMnO4)=0,0532моль/дм3). На титрування було витрачено 48,60см3 розчину калій перманганату. Розрахувати масову частку КClО3 у зразку.
Відповідь: 98,22%.
48. До розчину КСlО3 додали 50,00см3 розчину FeSO4 (c(  FeSO4)=0,1048моль/дм3), надлишок якого відтитрували розчином KMnO4 (c(
FeSO4)=0,1048моль/дм3), надлишок якого відтитрували розчином KMnO4 (c( 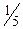 KMnO4)=0,0945моль/дм3). На титрування було витрачено 20,00см3 розчину калій перманганату. Яка маса КClО3 містилася у розчині?
KMnO4)=0,0945моль/дм3). На титрування було витрачено 20,00см3 розчину калій перманганату. Яка маса КClО3 містилася у розчині?
Відповідь: 0,06843г.
49. Визначити масову частку Sn у бронзі, якщо на титрування розчину, отриманого розчиненням 0,9122г бронзи, використано 15,73см3 розчину йоду (с(½І2)=0,03523моль/дм3).
Відповідь: 3,61%.
50. Технічний Na2SO3 масою 1,5000г розчинили у воді і до утвореного розчину додали 100,0см3 розчину І2 (с(½І2)=0,1000моль/дм3). На титрування надлишку І2 використано 40,00см3 розчину, в 200,0см3 якого міститься 2,4820г Na2S2O3. Визначити масову частку Na2SO3 у зразку.
Відповідь: 73,31%.
51. До кислого розчину калій йодиду додали 20,00см3 розчину KMnO4 (c( 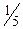 KMnO4)=0,1133моль/дм3). Йод, що виділився, відтитрували розчином натрій тіосульфату. На титрування було використано 25,90см3 розчину Na2S2O3. Яка молярна концентрація еквівалента розчину натрій тіосульфату?
KMnO4)=0,1133моль/дм3). Йод, що виділився, відтитрували розчином натрій тіосульфату. На титрування було використано 25,90см3 розчину Na2S2O3. Яка молярна концентрація еквівалента розчину натрій тіосульфату?
Відповідь: 0,08749моль/дм3.
52. Руду масою 0,6215г, що містить Купрум, відповідним чином розчинили і перевели Купрум у розчин у вигляді Сu2+. При додаванні до отриманого розчину надлишку КІ виділився І2, на титрування якого використали 18,23см3 розчину Na2S2O3 (T(Na2S2O3/Cu2+) =0,006208г/см3). Визначити масову частку Купруму в руді.
Відповідь: 5,67%.
53. До підкисненого розчину Н2О2 додали надлишок КІ і декілька крапель розчину (NH4)2MoO4 як каталізатора. Йод, що виділився, відтитрували розчином натрій тіосульфату (с(Na2S2O3)=0,1010моль/дм3). На титрування було витрачено 22,40см3 розчину Na2S2O3. Яка маса Н2О2 містилась у розчині?
Відповідь: 0,03845г.
54. У мірну колбу, об’ємом 250,0см3 вмістили 3,3590г білильного вапна і додали води до риски. На титрування 25,00см3 отриманої суспензії після відповідної обробки було використано 18,29см3 розчину Na2S2O3, титр якого становить 0,015634г/см3. Яка масова частка активного хлору в білильному вапні?
Відповідь: 19,08%.
55. Технічний FeCl3 масою 4,8900г розчинили у воді у мірній колбі об’ємом 250,0см3 і довели водою до риски. До 25,00см3 отриманого розчину в кислому середовищі додали надлишок КІ. Йод, що виділився, відтитрували розчином натрій тіосульфату (с(½Na2S2O3)=0,0923моль/дм3). На титрування було витрачено 33,0см3 розчину тіосульфату. Яка масова частка FeCl3 у зразку?
Відповідь: 98,28%.
56. З 3,2057г сплаву осадили свинець у вигляді PbCrO4. Дією на осад кислотою і надлишком КІ виділили І2, на титрування якого витратили 9,15см3 розчину Na2S2O3 (c(½Na2S2O3)=0,1028моль/дм3). Яка масова частка свинцю у сплаві?
Відповідь: 2,03%.
57. Руду масою 0,2000г, що містить MnO2, обробили концентрованим розчином хлоридної кислоти. Хлор, що утворився в результаті реакції, відігнали і поглинули розчином KI. Йод, що виділився відтитрували розчином натрій тіосульфату (с(½Na2S2O3)=0,0520моль/дм3). На титрування було використано 42,50см3 розчину натрій тіосульфату. Яка масова частка MnO2 у руді?
Відповідь: 48,03%.
58. До 25,00см3 розчину H2S додали 50,00см3 розчину І2 (с(½І2)=0,0196моль/дм3). Надлишок І2 відтитрували розчином натрій тіосульфату (с(½Na2S2O3)= =0,0204моль/дм3). На титрування було витрачено 11,00см3 розчину натрій тіосульфату. Яка маса H2S містилась в 1дм3 досліджуваного розчину?
Відповідь: 0,5150г.
59. Розрахувати масу K2Cr2O7, щоб на титрування І2, який виділився при взаємодії його з надлишком КІ, витратити 35,42см3 розчину Na2S2O3 з Т(Na2S2O3/I2)=0,01270г/см3.
Відповідь: 0,0159г.
60. Установлено, що 50,00см3 розчину І2 за своєю окисною здатністю еквівалентні 49,47см3 розчину К2Cr2O7, 1,00см3 якого виділяє з КІ 0,004263г І2. Які молярні концентрації еквівалентів обох розчинів?
Відповідь: І2 – 0,03328моль/дм3; К2Cr2O7 – 0,03858моль/дм3.
61. Розрахувати індикаторну похибку титрування розчину NaOH (c(NaOH)=0,1моль/дм3) розчином НCl (с(НCl)=0,1моль/дм3) з індикатором тимолфталеїном (рТ=10).
Відповідь: 0,2%.
62. З яким індикатором можна відтитрувати розчин CH3COOH, щоб кислотна похибка не перевищувала 0,1%?
Відповідь: фенолфталеїном, тимолфталеїном.
63. Розрахувати індикаторну похибку титрування розчину НCl (с(НCl)=0,2моль/дм3) розчином NaOH (с(NaOH)=0,2моль/дм3) з індикатором метиловим червоним (pT=5).
Відповідь: 0,01%.
Частина IV
Фізико-хімічні методи аналізу
Розділ 14
Оптичні методи аналізу
Фізико-хімічні методи аналізу поділяються на оптичні, електрохімічні, хроматографічні.
До оптичного діапазону відноситься електромагнітне випромінювання з довжиною хвилі від 100 до 10000нм.
Випромінювання з довжиною хвилі 100-380нм – невидиме та відноситься до ультрафіолетової зони.
Видима частина спектра лежить в діапазоні довжини хвиль 380-760нм.
Випромінювання з довжиною хвилі 760–10000нм теж невидиме та складає інфрачервону зону.
У залежності від характеру взаємодії речовини з випромінюванням оптичні методи аналізу поділяються на:
§ абсорбційні (ґрунтуються на вимірюванні поглинання світла речовиною). До таких методів відносяться колориметрія, фотоколориметрія, спектрофотометрія, атомно-абсорбційний аналіз;
§ емісійні (ґрунтуються на вимірюванні інтенсивності випромінювання світла речовиною). До цих методів відносяться люмінесцентний аналіз, емісійний спектральний аналіз, полум’яна фотометрія.
Методи, що ґрунтуються на взаємодії світлового потоку із суспензіями, поділяються на:
§ турбідіметрію (вимірювання послаблення світлового потоку при його проходженні через незабарвлену суспензію);
§ нефелометрію (вимірювання інтенсивності світла, яке відбивається або розсіюється суспензією).
Методи, що ґрунтуються на явищі поляризації молекул під дією світлового випромінювання, поділяються на:
§ рефрактометрію (вимірювання показника заломлення світла при переході з одного середовища в інше);
§ поляриметрію (вимірювання кута обертання площини поляризації поляризованого світла при його проходженні через оптично активне середовище);
§ інтерферометрію (вимірювання зсуву інтерференції світла при проходженні його крізь кювети з розчином речовини, розчинником та крізь коліматор).
Дата добавления: 2020-10-14; просмотров: 1142;











