СРЕДСТВА СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ, ТЕРАПИИ И ДИАГНОСТИКИ ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ 8 глава
Кроме того, выпускают инактивированные вакцины, содержащие три серовара P. multocida (А, В, D).
Гемофилезный полисерозит. Септическое заболевание поросят раннего послеотъемного периода. Характеризуется серозно-фибринозным воспалением плевры, перикарда, брюшины, суставов, иногда отмечают менингоэнцефалит.
Возбудитель — Haemophilus parasuis, род Haemophilus, семейство Pasteurellaceae.
Лабораторная диагностика гемофилезного полисерозита основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим, ферментативным и патогенным свойствам.
Материал для исследования. Стерильно отбирают серозно-фибринозный экссудат из перитонеальной, плевральной, перикардиальной полостей, пораженных суставов, а также пораженные серозные оболочки.
Микроскопия препаратов из исходного материала. Мазки окрашивают по Граму и на капсулы бактерий. Н. parasuis— мелкие тонкие грамотрицательные палочки, без спор и жгутиков, образуют капсулу. Возбудитель обнаруживают в виде полиморфных грамотрицательных палочек, диплобактерий, коротких цепочек из палочек, а также в виде нитей.
Выделение и идентификация культуры возбудителя. Факультативный анаэроб, температурный оптимум 37...38 °С. Так как возбудитель — ауксотроф по коферменту ДПН, он не растет на обычных питательных средах. Материал засевают на «шоколадный» агар в чашках Петри и кровяной МПА с бактерией - «кормилкой».
«Шоколадный агар»: к расплавленному МПА (рН 7,2...7,4) температурой 80...90°С добавляют 10% стерильной дефибринированной крови барана или лошади. Компоненты перемешивают и после охлаждения до 50...80 ºС среду разливают по чашкам Петри, пробиркам.
На кровяной МПА (5 % крови барана, кролика, лошади) исследуемый материал засевают шпателем по всей поверхности среды. Затем по диаметру чашки в виде двух прямых линий под углом 90° засевают культуру негемолитического штамма S. epidermidis или Е. coli. Посевы инкубируют при 37...38 ºС 24...48 ч в условиях обычной атмосферы.
На «шоколадном» МПА возбудитель формирует мелкие, круглые, прозрачные, с ровными краями и гладкой поверхностью колонии. На кровяном МПА возбудитель растет в виде мельчайших негемолитических колоний только вблизи «штриха» бактерии - «кормилки» на удалении не более 0,5...1,0 см (рис.105). Такой рост H. parasuis называют «сателлитным»; он связан с тем, что бактерия - «кормилка» синтезирует ДПН, который диффундирует в толщу агаровой среды и в этой зоне способен расти ауксотроф H. parasuis. «Шоколадный» агар содержит ДПН, выделенный из разрушенных эритроцитов, и поэтому H. parasuis растет по всей поверхности питательной среды. Для проверки у культуры бактерий зависимости от ДПН ее дополнительно высевают на сывороточный «шоколадный» агар. Культуры возбудителя растут на «шоколадном» и не растут на сывороточном МПА, поскольку в последнем отсутствует ДПН.

Рис. 105. Рост сателлитиых колоний гемофильных бактерий:
а — «штрих» бактерии - «кормилки»;
б— мелкие сателлитные колонии гемофильных бактерий
Из подозрительных колоний на «шоколадном» агаре или «сателлитных» колоний на кровяном агаре готовят мазки, окрашивают по Граму, на капсулы по методу Гинса, определяют наличие жгутиков в препарате «раздавленная капля»: Н. parasuis неподвижен.
У культур исследуют уреазную активность посевом на среду Заксе: раствор А: 96%-й этанол —2 мл и дистиллированная вода —4 мл; раствор Б: дистиллированная вода — 100 мл, дигидрофосфат калия —0,1 г, гидрофосфат калия —0,12 г, хлорид натрия—0,5 г, добавляют 1 мл 2%-го раствора фенолового красного. Смешивают растворы А и Б в соотношении 1:19; смесь разливают по 0,1 мл в уленгутовские пробирки и вносят бактериологическую петлю исследуемой культуры. Пробирки выдерживают при 37...38 °С 30...40 мин и учитывают результат. В положительном случае раствор за счет расщепления мочевины и защелачивания среды приобретает малиново-красный цвет. Н. parasuis уреазу не вырабатывает.
Биопроба. Метод применяют для определения вирулентных свойств культур Н. parasuis. Суточной агаровой культурой в дозе 2*109 микробных клеток заражают внутрибрюшинно морских свинок массой 300...350 г. Наблюдение за животными ведут в течение 5 сут.
Актинобациллезная (гемофилезная) плевропневмония. Инфекционная болезнь свиней преимущественно двух-трехмесячного возраста и откормочных животных. Характеризуется развитием фибринозно-геморрагической некротизирующей пневмонии и фибринозного плеврита.
Возбудитель — бактерия Actinobacillus pleuropneumoniae, род ActinobaciUus, семейство Pasteurellaceae.
Лабораторная диагностика актинобациллезной плевропневмонии свиней основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим, ферментативным и серологическим свойствам.
Материал для исследования. В лабораторию направляют кусочки пораженных легких, средостенные и бронхиальные лимфатические узлы.
Микроскопия препаратов из исходного материала. Мазки-отпечатки окрашивают по Граму и одним из методов для выявления капсулы. A. pleuropneumoniae — короткие грамотрицательные палочки с закругленными концами, чаще располагаются в виде парных коккобактерий, могут образовывать короткие цепочки, нитевидные формы, формируют капсулу, спор нет. Возбудитель в исследуемом материале обнаруживают в форме мелких коккобактерий, коротких палочек, окруженных капсулой, расположенных единично, парами, в виде коротких цепочек (рис. 106, 107).
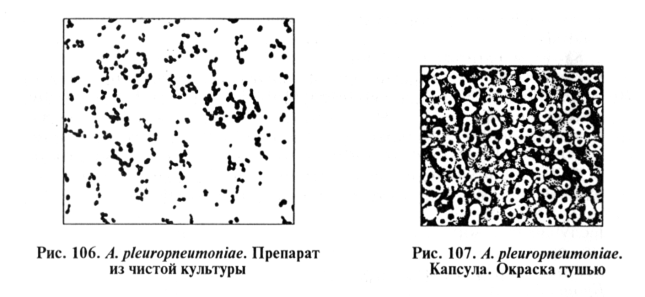
Выделение и идентификация культуры возбудителя. Факультативный анаэроб, температурный оптимум 37...38 °С, рН 7,2...7,4. Известны два биовара возбудителя: ДПН-зависимый (Первый биовар), ДПН-независимый (Второй биовар).
Исследуемый материал засевают на 5%-й кровяной МПА с «бактерией-кормилкой» или «шоколадный» и сывороточно-дрожжевой МПА, в МПБ (5 % сыворотки крови крупного рогатого скота, 10 % дрожжевого экстракта). Дрожжевой экстракт служит источником ДПН. Посевы инкубируют в условиях обычной атмосферы при 37...38 ºС 24 ч.
При зараженности материала ДПН-зависимым возбудителем на кровяном МПА обнаруживают «сателлитные» мелкие (0,1...0,2 мм), гладкие, выпуклые, с ровными краями слизистые колонии, окруженные зоной бета-гемолиза. ДПН-независимые штаммы растут по всей поверхности кровяного МПА без «сател-литного» феномена. На «шоколадном» агаре оба биовара A. pleuropneumoniae формируют серо-белые колонии диаметром 1,0...2,6 мм правильной круглой формы, выпуклые, с гладкой поверхностью, ровными краями, слизистой консистенции.
На сывороточно-дрожжевом МПА колонии возбудителя серо-белые, полупрозрачные, диаметром 1...2мм, правильной круглой формы, с ровными краями, гладкой поверхностью. При исследовании колоний на этой среде в пучке косопроходящего света в бинокулярной лупе они видны как ярко-зеленые с красноватым оттенком, при наблюдении в косопроходящем свете невооруженным глазом флуоресцируют.
В сывороточно-дрожжевом МПБ возбудитель растет с равномерным, средней интенсивности помутнением среды, позднее (48...72 ч) на дне пробирки образуется серо-белый осадок.
Из подозрительных колоний готовят мазки, окрашивают по Граму, на капсулы — по Гинсу, определяют наличие жгутиков микроскопией препарата «раздавленная капля». В мазках из культур возбудитель обнаруживают в форме коротких грамотрицательных палочек с закругленными концами, вплоть до кокковидных, окруженных капсулой.
У культур с типичными для A. pleuropneumoniae признаками изучают ферментативные свойства. Возбудитель выделяет уреазу, щелочную фосфатазу, ДПН-зависимый (Первый биовар), разлагает с образованием кислоты без газа ксилозу, маннит, не утилизирует сорбит, салицин, мелибиозу, цитраты, не образует индол.
Известны 12 сероваров возбудителя. При необходимости устанавливают серовариантную принадлежность культуры в РДП, пробирочной РА.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Описать культуральные свойства P. multocida, Н. parasuis, A. pleuropneumoniae.
2. Приготовить мазки из культур P. nultocida, Н. parasuis, A. pleuropneumoniae, окрасить по Граму, Гинсу, промикроскопировать, зарисовать.
3. Изучить ферментативные свойства P. multocida, Н. parasuis, A. pleuropneumoniae и методы определения сероваров пастерелл (демонстрация).
4. Провести бактериологическое исследование трупов мышей, зараженных P. multocida.
Контрольные вопросы
1. Каковы морфологические и тинкториальные свойства возбудителей пасте-реллеза, гемофилезного полисерозита и актинобациллезной плевропневмонии?
2. Каковы ферментативные свойства P. multocida, Н. parasuis, A. pleuropneumoniae?
3. Какими методами определяют ДПН-зависимость Н. parasuis и A. pleuropneumoniae?
4. Какими методами определяют серовары P. multocida?
5. Какие выпускают противопастереллезные биопрепараты?
Тема 34
Дата добавления: 2016-07-22; просмотров: 2096;











