ЛАБОРАТОРНАЯ ДИАГНОСТИКА МИКОПЛАЗМОЗОВ, РИККЕТСИОЗОВ И ХЛАМИДИОЗОВ. БИОПРЕПАРАТЫ
Цель занятия. Ознакомить студентов со свойствами возбудителей, методами лабораторной диагностики микоплазмозов, риккетсиозов, хламидиозов, а также биопрепаратами.
Оборудование и материалы. Культуры микоплазм на жидких и плотных питательных средах, готовые фиксированные препараты риккетсий (вакцинный штамм), хламидий, красители для окраски по Стемпу, биопрепараты.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Контагиозная перипневмония крупного рогатого скота (повальное воспаление легких). Инфекционная болезнь, протекающая в виде крупозной пневмонии и плеврита с последующим развитием анемических некрозов в легких.
Возбудитель контагиозной перипневмонии крупного рогатого скота — М. mycoides subsp. mycoides, род Mycoplasma, семейство Mycoplasmataceae.
Лабораторная диагностика перипневмонии крупного рогатого скота основана на результатах бактериологического и серологического исследований.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии и биопробы, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим, ферментативным, серологическим и патогенным свойствам.
Материал для исследования. Для прижизненной диагностики используют бронхиальную слизь, секрет молочной железы, мочу, а для посмертной (от животных, убитых с диагностической целью — в начале болезни или не позднее 2...3 ч после гибели) — асептично полученный плевральный экссудат, медиастинальные, бронхиальные лимфоузлы, пораженные участки легких. Материал помещают в стерильную посуду и пересылают в лабораторию нарочным в термосе со льдом или в замороженном виде.
Микроскопия препаратов из исходного материала. Для микоплазм характерен выраженный полиморфизм, что обусловлено отсутствием ригидной клеточной стенки. Средние размеры микоплазм 0,1...0,2 мкм. В ранней экспоненциальной стадии роста форма клеток сферическая или овальная, позднее клетки удлиняются вплоть до нитей (рис. 112). Из исследуемого материала готовят мазки, окрашивают по методу Романовского—Гимзы или Грама. Краску Романовского—Гимзы разводят дистиллированной водой в соотношении 1 : 10 и препараты окрашивают в течение 24 ч при комнатной температуре. Клетки микоплазм обнаруживают в форме кокков, дисков, гроздевидных скоплений, тонких разветвленных нитей.
Выделение и идентификация культуры возбудителя. Для получения культуры возбудителя исследуемый материал высевают на плотные и жидкие питательные среды. Микоплазмы прихотливы к условиям культивирования, поэтому в питательные среды добавляют дрожжевой экстракт, сыворотку крови, витамины, углеводы. Наиболее часто используют жидкую и плотную среды Мартена, представляющие собой кислотный гидролизат фарша из свежих свиных желудков. Нередко применяют среду Эдварда, состоящую из отвара сердечной мышцы, воды, пептона, после стерилизации добавляют 20 % инактивированной сыворотки крови лошади или крупного рогатого скота и 10 % дрожжевого экстракта. В питательные среды для первичной изоляции добавляют ингибиторы, тормозящие рост сопутствующей бактериальной микрофлоры: пенициллин, подавляющий рост грамположительных бактерий, но не действующий на микоплазмы; ацетат таллия, ингибирующий грамотрицательные бактерии. Посевы инкубируют при 37...38 °С.
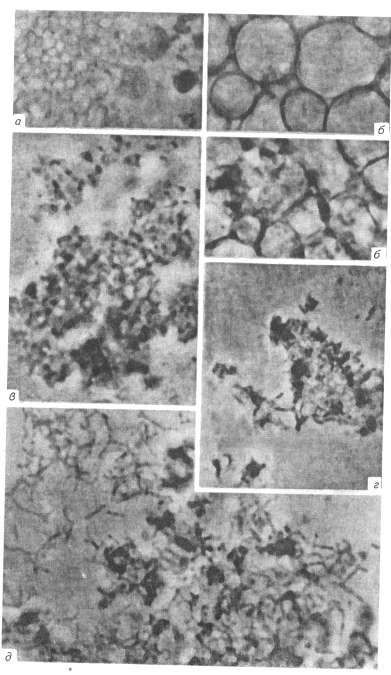
Рис. 112. Микроструктура разных видов микоплазм (х1350):
а — шаровидные тела различных размеров и разной оптической плотности;
б— гигантские вакуолизированные тела;
в — мелкие сферические формы М. hominisw не имеющие определенной формы тела;
г — зернистые формы;
д — ветвистые нитевидные формы и стрептококкоподобные формы
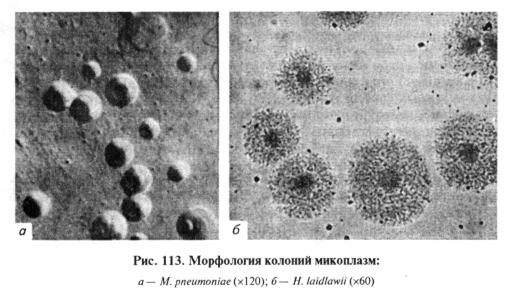
В жидких питательных средах рост возбудителя в виде опалесценции различной интенсивности появляется на 2...3-й сутки. На плотных средах возбудитель формирует круглые с ровными краями колонии, напоминающие яичницу-глазунью, центр колонии в виде сосочка оптически более плотный, врастает в толщу среды (рис.113). На кровяном агаре колонии окружены зоной альфа-гемолиза.
У выделенных культур изучают ферментативные свойства. Возбудитель ферментирует глюкозу, мальтозу, маннозу, галактозу, декстрин, образует сероводород, редуцирует хлорид тетразола, мочевину не расщепляет.
Для идентификации микоплазм предложена реакция иммунофлуоресценции. На поверхность агаровой среды в чашках засевают микоплазмы, чашки выдерживают в термостате 3...5 дней. Затем в них вносят 2 мл ФСБР на 30 мин, сливают и наносят на агар 2 мл меченой ФИТЦ-антисыворотки в рабочем титре (при непрямом методе применяют немеченую сыворотку), выдерживают при 37 °С 30 мин, сливают и трижды промывают буфером, после чего просматривают колонии под люминесцентным микроскопом. Колонии, окрашенные гомологичной сывороткой, ярко флуоресцируют. Для изучения антигенной структуры микоплазм применяют реакцию диффузионной преципитации в агаровом геле (РДП). При постановке реакции используют растворимый антиген, который получают путем многократного замораживания и оттаивания микоплазм (до 20 раз), воздействия ультразвуком (при 20 кГц — 3 мин) или детергентами (твин-20, додецилсульфат натрия).
Биопроба. Заражают двух-трех здоровых телят 6...8-месячного возраста подкожно в область подгрудка, интратрахеально или интраплеврально экссудатом от больных животных или культурой. За животными ведут наблюдение в течение 30 дней. В положительных случаях телята заболевают на 2...7-й день, температура поднимается до 40...41 °С, развивается общая интоксикация организма; при подкожном методе заражения в месте введения образуется флегмона, в процесс вовлекаются регионарные лимфоузлы. Гибель обычно наступает через 17 сут.
Серологическая диагностика включает в себя постановку РСК, РИГА, проведение ИФА. Для прижизненного выявления больных применяют РСК, которую ставят по общепринятой методике. Антиген для реакции готовят на биофабриках из плевральной жидкости от экспериментально зараженных животных; выпускают и культуральные антигены. В качестве диагностического теста используют реакцию непрямой гемагглютинации, чувствительность которой в острой фазе болезни выше, чем чувствительность РСК. Для определения специфических антител к микоплазмам в сыворотке крови животных применяют метод иммуноферментного анализа.
Инфекционная плевропневмония коз. Это контагиозное заболевание коз всех пород и возрастов. Характеризуется воспалением легких, плевры, серозным воспалением междолевой серозной ткани, скоплением экссудата в плевральной полости.
Возбудитель инфекционной плевропневмонии коз — М. mycoides subsp. capri, род Mycoplasma, семейство Mycoplasmataceae.
Лабораторная диагностика инфекционной плевропневмонии коз основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим, ферментативным и патогенным свойствам.
Материал для исследования. В лабораторию направляют сердце, легкие, бронхиальные и средостенные лимфатические узлы, экссудат грудной полости, печень, селезенку павших или вынужденно убитых животных. Экссудат из грудной полости набирают стерильным шприцем (2...5 мл). Для исследования пригоден свежий материал, который пересылают в лабораторию в стерильной посуде в термосе со льдом или в замороженном состоянии. Замороженный материал хранят не более 10сут.
Микроскопия препаратов из исходного материала. Мазки-отпечатки фиксируют этанолом 15...20 мин, окрашивают при комнатной температуре в течение 24 ч краской Романовского—Гимзы, разведенной дистиллированной водой в соотношении 1 : 10, после чего промывают и микроскопируют. В положительных случаях обнаруживают мелкие полиморфные образования кокковидной, кольцевидной, нитевидной форм розового цвета. В мазках, окрашенных по Граму, наблюдают грамотрицательно окрашенную аморфную массу.
Выделение и идентификация культуры возбудителя. Для выделения культуры возбудителя инфекционной плевропневмонии коз применяют жидкие питательные среды Мартена, Эдварда и триптический перевар сердца крупного рогатого скота. Посевы помещают в термостат при 37...38 ºС на 5...7 дней.
На жидких средах рост возбудителя проявляется незначительным помутнением или опалесценцией, на агаре — мелкими росинчатыми колониями. Под малым увеличением микроскопа у них обнаруживают темный, врастающий в агар центр и светлую периферийную зону. Колонии напоминают по внешнему виду яичницу-глазунью.
Возбудитель ферментирует глюкозу, маннозу, сахарозу, вызывает разжижение свернутой сыворотки и гидролиз желатины, фосфатазная активность не выражена.
Биопроба. Для подтверждения диагноза инфекционной плевропневмонии коз ставят биопробу на двух 6... 12-месячных козлятах. Для заражения используют 3...4-суточную свежевыделенную культуру микоплазм или суспензию из исследуемого материала на физиологическом растворе
(1 : 10). Козлят заражают внутри-плеврально по 10 мл. В положительных случаях у животных через 2... 15 дней отмечают повышение температуры тела, одышку. Гибель наступает через 1...3 нед. Из пораженных легких и плеврального экссудата выделяют культуру возбудителя.
Инфекционная агалактия овец и коз. Контагиозное заболевание. Характеризуется прекращением лактации, поражением молочной железы, глаз и суставов. У беременных животных проявляется абортами. Гибель животных при остром течении болезни наступает через 5...8 дней.
Возбудитель — микоплазма М. agalactiae, род Mycoplasma.
Лабораторная диагностика инфекционной агалактии мелкого рогатого скота основана на результатах бактериологического и серологического исследований.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии и биопробы. При отрицательных результатах биопробы выделяют чистую культуру посевом на питательные среды и идентифицируют возбудитель по культурально-морфологическим и ферментативным свойствам.
Материал для исследования. При заболевании вымени в лабораторию направляют молоко, при поражении суставов — синовиальную жидкость; от павших животных — паренхиматозные органы, лимфатические узлы, пораженную часть вымени, пораженный глаз, синовиальную жидкость.
Микроскопия препаратов из исходного материала. Мазки-отпечатки окрашивают по Граму и по Романовскому—Гимзе. В препаратах, окрашенных по Романовскому—Гимзе, в положительных случаях выявляют мелкие полиморфные образования розового цвета кокковидной, кольцевидной или нитевидной формы.
Выделение и идентификация культуры возбудителя. Возбудитель растет на агаре и в бульоне Мартена с добавлением 15...20 % сыворотки лошади или крупного рогатого скота; на средах Эдварда и Хоттингера с добавлением сыворотки и 1...2% лактозы, на триптическом переваре сердца крупного рогатого скота.
На жидких средах на 5...7-й день появляется слабая опалесценция или незначительное помутнение. На плотных средах образуются мелкие колонии, напоминающие яичницу-глазунью (просматривают с помощью линзы). При отсутствии роста проводят не менее 5 последовательных пассажей с интервалом 5...7 дней. Отсутствие роста в 5...7-м пассажах указывает, что исследуемый материал не содержит возбудитель инфекционной агалактии мелкого рогатого скота. Микоплазмы также выращивают в клеточных культурах, используя клетки почки эмбриона овцы, куриные фибробласты.
М. agalactiae не ферментирует глюкозу и маннозу, не гидролизует аргинин и желатину, не разжижает свернутую сыворотку, обладает фосфатазной активностью.
Биопроба. Ставят на кроликах массой 2,5...3 кг или на животном того вида (овцы или козы 1...2-месячного возраста), от которого выделена культура. Для заражения используют суспензию исследуемого материала, обработанную ингибиторами (ацетат таллия и пенициллин), или чистую культуру микоплазм. Кроликов заражают введением в переднюю камеру глаза 0,1...0,2 мл материала с предварительным удалением тонкой иглой из камеры 0,1...0,05 мл жидкости. В другой глаз для контроля таким же образом вводят стерильный бульон. Через 5...12 дней в положительном случае у подопытных кроликов развивается кератит. Наблюдение ведут в течение 30 дней. При наличии кератита биопробу считают положительной, выделение культуры необязательно.
Овец и коз заражают, вводя материал в молочный канал, или подкожно по 5 мл, или в сустав по 2 мл. В положительных случаях через 2...30 дня после введения материала у животных развивается клиническая картина инфекционной агалактии мелкого рогатого скота.
Срок исследования без постановки биопробы 30 дней, с биопробой и последующим выделением возбудителя — до 90 дней.
Серологическая диагностика основана на результатах исследования сывороток в РСК.
Респираторный микоплазмоз птиц. Это контагиозная болезнь кур и индеек. Характеризуется поражением органов дыхания. У птиц развивается катаральный ринит с последующей одышкой, кашлем; катаральный ринит переходит в серозно-фибринозный, у некоторых птиц возникают конъюнктивит, синусит, припухлость в области межчелюстного пространства. Птица становится малоподвижной, оперение взъерошено, гребень бледный, снижаются приросты массы у молодняка и яйценоскость у несушек. У индеек типичный признак — воспаление подглазничных синусов. У взрослой птицы заболевание может протекать бессимптомно.
Возбудитель — М. gallinarum, род Mycoplasma.
Лабораторная диагностика респираторного микоплазмоза птиц основана на результатах бактериологического и серологического исследований.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры и идентификацию возбудителя по культурально-морфологическим, ферментативным и патогенным свойствам.
Материал для исследования. От свежих трупов птиц берут со-скобы со слизистых оболочек гортани, трахеи, головной мозг, а также кусочки легкого и стенки воздухоносных мешков. При отсутствии патологических изменений у взрослой птицы на исследование направляют легкие, желточный мешок, трахею эмбрионов последних дней инкубации и 1...2-суточных цыплят.
Микроскопия препаратов из исходного материала. В мазках, окрашенных по методу Романовского—Гимзы, микоплазмы обнаруживают в виде мельчайших полиморфных коккобактерий фиолетового или голубого цвета, беспорядочно расположенных по всему полю зрения (рис. 114).

Выделение и идентификация культуры возбудителя. Посевы из исследуемого материала делают на среды Эдварда, Хоттингера, Мартена.
Рост возбудителя микоплазмоза на жидких средах характеризуется едва заметной опалесценцией или нежным помутнением среды. На плотных средах микоплазмы образуют круглые мелкие бесцветные колонии с гладкой или пуговчатой поверхностью, хорошо различимые при малом увеличении микроскопа. Для активизации роста микоплазм проводят не менее 5 пассажей с интервалами между посевами в 5 дней. Посевы инкубируют при температуре 37...38 °С.
Возбудитель микоплазмоза птиц утилизирует глюкозу, маннозу, мальтозу, образует аммиак, редко сероводород, индол. Не гидролизует желатину и аргинин, не обладает фосфатазной активностью, агглютинирует эритроциты птиц.
Биопроба. Для определения патогенности выделенных микоплазм куриные или индюшиные
9-дневные эмбрионы заражают в хорионаллантоисную полость культурой на жидкой питательной среде по 0,2 мл. Используют не менее 15 эмбрионов. Яйца инкубируют при 38...40°С и ежедневно просматривают в овоскопе. При вскрытии эмбрионов, погибших через 48 ч и позднее, отмечают дегенеративные изменения: артриты, отеки и кровоизлияния на коже головы, теле, лапках, застойные явления в паренхиматозных органах, пневмонию. Наличие возбудителя определяют при посевах на специальные питательные среды. Биопробу считают положительной при гибели не менее 50 % зараженных эмбрионов и выживании контрольных.
Серологическая диагностика включает в себя постановку следующих реакций: капельной агглютинации с цельной кровью или сывороткой крови; торможения гемагглютинации (РТГА), ингибирования роста, РСК, а также применяют метод иммунофлуоресценции. Серологические методы диагностики микоплазмоза птиц еще недостаточно совершенны.
Биопрепараты. Антиген для диагностики респираторного микоплазмоза птиц (лиофилизированный) готовят из штамма М. gallisepticum S6. Антиген применяют в сывороточно-капельной реакции агглютинации на стекле для постановки эпизоотического диагноза на респираторный микоплазмоз птиц.
Риккетсиозы. Риккетсии относят к группе грамотрицательных бактерий — облигатных внутриклеточных паразитов. В зависимости от способа размножения их подразделяют на два порядка: Rickettsiales и Chlamydiales. В порядок Rickettsiales включено 3 семейства: Rickettsiaceae, Bartonellaceae и Anaplasmataceae.
В семейство Rickettsiaceae включены мелкие палочковидные и диплококковидные внутриклеточные микроорганизмы, чаще обитающие в тканях членистоногих, способные вызвать заболевание у животных и человека.
По морфологии различают четыре основных типа риккетсии: кокковидные (диаметр 0,3... 1 мкм); палочковидные биполярные (1...1,5 мкм); удлиненные биполярные, часто изогнутые (З...4мкм); нитевидные полизернистые (10...40 мкм) (рис.115). Кокковидные формы окрашиваются по Романовскому—Гимзе и Цилю—Нильсену в красный цвет, палочковидные и нитевидные — в красно-голубой (зерна красные, цитоплазма между ними голубая); по Здродовскому — в красный. Метод Здродовского — облегченная модификация способа Циля—Нильсена (карболовый фуксин Циля разводят в следующем соотношении: 10... 15 капель на 10 мл дважды дистиллированной воды или фосфатного буфера рН 7,4). Тонкослойный препарат высушивают на воздухе и фиксируют над пламенем, окрашивают разведенным фуксином в течение 5 мин. Затем промывают водой, быстро (1...3 с) обрабатывают кислотой (0,5%-й раствор лимонной, 0,15%-й раствор уксусной и др.), промывают водой и докрашивают 0,5%-м водным раствором метиленовой сини 10 с, промывают, подсушивают фильтровальной бумагой.
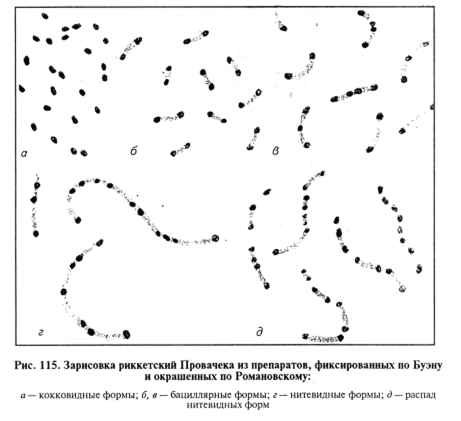
Риккетсии размножаются делением. Вне организма развиваются только в культуре растущей и переживающей ткани, на оболочках куриных эмбрионов.
Ку-риккетсиоз (Ку-лихорадка) (от англ. query — сомнения, сомневаться). Природно-очаговая зооантропонозная болезнь домашних, промысловых и диких млекопитающих животных и птиц. Протекает чаще бессимптомно, но может встречаться также в острой и хронической формах. Клинические признаки болезни: повышение температуры, ринит, пневмония, конъюнктивит, поражение половых органов, маститы, у быков — орхиты, рождение нежизнеспособного потомства, аборты.
Возбудитель Ку-риккетсиоза — Coxiella burneti, род Coxiella, семейство Rickettsiaceae.
Лабораторная диагностика Ку-риккетсиоза основана на результатах бактериологического и серологического исследований.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии и биопробы, выделение чистой культуры методом биопробы и идентификацию возбудителя по морфологическим и серологическим свойствам.
Материал для исследования. Для прижизненной диагностики в лабораторию направляют кровь из вены; клещей, собранных с животных; выделения из матки и влагалища; плаценты от абортировавших животных; от павших и убитых с диагностической целью животных берут участки пораженного легкого, головного мозга, селезенки, паренхимы вымени, регионарные лимфоузлы.
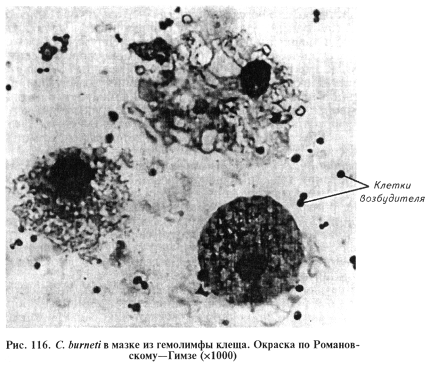
Микроскопия препаратов из исходного материала. При микроскопии мазков, окрашенных по методам Романовского—Гимзы и Здродовского, можно обнаружить коккоподобные (диаметр 0,2...0,5 мкм), палочковидные (2 мкм) и нитевидные (10...12 мкм) формы, расположенные одиночно, попарно и короткими цепочками, которые могут находиться внутри клеток тканей и вне клеток. По методу Здродовского риккетсии будут красного цвета на голубом фоне, по Романовскому—Гимзе кокковидные формы красные; палочковидные и нитевидные красно-голубые (рис. 116).
Выделение и идентификация культуры возбудителя. Из исходного материала готовят суспензию на физиологическом растворе (1: 10), в которую добавляют антибиотики и вводят 0,2...0,25 мл в желточный мешок 5...6-суточных куриных эмбрионов. Проводят 4...6 пассажей. При положительном результате отмечают отставание в развитии и гибель зараженных эмбрионов. Риккетсии обнаруживают микроскопически в мазках, приготовленных из оболочек желточного мешка. Иногда используют культуры клеток куриных и мышиных фибробластов.
Для обнаружения и идентификации возбудителя используют реакцию иммунофлуоресценции, метод иммуноферментного анализа.
Биопроба. Для выделения риккетсии Бернета и подтверждения их патогенности заражают двух молодых морских свинок (массой 250...300 г) или четырех молодых белых мышей исходным материалом (суспензия на физиологическом растворе 1:5, обработанная антибиотиком) или эмбриональной культурой. Материал вводят внутрибрюшинно свинкам по 3...5 мл и мышам по 0,5... 1 мл. Для получения более четких результатов проводят от 3 до 5 «слепых» пассажей. В последних пассажах у морских свинок через 3...10 дней после заражения появляется лихорадка, и животные через 3...12 дней погибают, при вскрытии у них отмечают увеличение печени, селезенки и лимфоузлов.
Серологическая диагностика основана на результатах РСК, в которой исследуют сыворотки крови больных животных. При получении положительных результатов (на 3 и 4 креста) реакцию повторяют для подтверждения полученных данных.
Эрлихиоз собак. Это трансмиссивная лихорадочная болезнь. Характеризуется истощением, панцитопенией, геморрагиями на коже и слизистых оболочках. Возбудитель — Е. canis, род Erlichia, семейство Rickettsiaceae. Наиболее восприимчивы к эрлихиозу собак немецкая овчарка и гончая, болеют лисы, макаки-резус, койоты. Лабораторные животные (мыши, крысы, морские свинки, хомячки) и куриные эмбрионы нечувствительны. Морфогенез возбудителя складывается из превращения элементарного тельца овальной или кокковидной формы (0,4 мкм) в инициальное тельце неопределенной формы размером 1...2мкм с последующей трансформацией в морулу (образования похожи на тутовую ягоду 2...4 мкм). Цикл развития завершается распадом морулы на элементарные тельца.
Лабораторная диагностика эрлихиоза собак заключается в световой микроскопии мазков крови, окрашенных по Романовскому—Гимзе, для определения морул возбудителя в лейкоцитах собак. Морулы обнаруживают, начиная с третьей недели болезни на протяжении 2...5 лет. Все формы Е. canis окрашиваются по Гимзе в голубой цвет, по Романовскому — в розовый.
Как метод серологической диагностики применяют непрямую реакцию иммунофлуоресценции с использованием зараженной культуры моноцитов в качестве антигена.
Эрлихиоз крупного и мелкого рогатого скота. Это трансмиссивная лихорадочная болезнь. У овец развиваются пневмонии, аборты, у баранов — бесплодие, у коров отмечают лихорадку, вялость, снижение удоев.
Возбудитель — Erlichia phagocytophila.
Лабораторная диагностика эрлихиоза крупного и мелкого рогатого скота основана на микроскопическом изучении окрашенных препаратов из материала. Морфологические и тинкториальные свойства возбудителя аналогичны Е. canis.
Гидроперикардит (коудриоз). Это заболевание жвачных и всеядных животных. Характеризуется лихорадкой, геморрагическим диатезом с образованием серозного экссудата в грудной и брюшной полостях.
Возбудитель — Cowdria ruminantum, род Cowdria, семейство Rickettsiaceae.
Лабораторная диагностика гидроперикардита основана на микроскопическом изучении окрашенных препаратов и на результатах биопробы.
Материал для исследования. В лабораторию направляют кровь от больного животного, костный мозг, селезенку.
Микроскопия препаратов из исходного материала. В положительных случаях в окрашенных препаратах из материала обнаруживают кокковидные, эллипсоидные (0,2...0,5 мкм) или палочковидные клетки размером (0,2...0,3) х (0,4...0,5) мкм, расположенные в вакуолях цитоплазмы клеток эндотелия, где образуют специфические компактные колонии. По Граму окрашивается отрицательно, по Гимзе — в темно-синий цвет. Особенно важное диагностическое значение имеет обнаружение возбудителя в эндотелии капилляров коры головного мозга.
Биопроба. Заражают естественно-восприимчивых животных путем внутривенного введения крови больного.
Хламидиозы. Возбудителей хламидиозов относят к порядку Chlamydiales, семейству Chlamydiaceae, включающему в себя один род Chlamydia с двумя видами: С. trachomatis и С. psittaci. Это грамотрицательные неподвижные кокковидные облигатные паразиты с выраженным полиморфизмом. С. trachomatis патогенен для человека и мышей, С. psittaci вызывает ряд инфекционных заболеваний у животных и птиц. Развитие патологического процесса зависит от места локализации возбудителя у животных. Хламидии чаще поражают респираторные органы и кишечный тракт у птиц, ягнят, телят, поросят, гениталии у крупного и мелкого рогатого скота, синовиальные ткани телят, поросят, ягнят, жеребят, слизистые оболочки глаз крупного рогатого скота, свиней, овец, кошек и др. Клинические проявления хламидиоза разнообразны: диарея, пневмонии, конъюнктивиты, полиартриты, перикардиты, энцефалиты, аборты, мертво-рождение, бесплодие, вагиниты, эндометриты и т. д. К С. psittaci восприимчивы дикие и домашние птицы — свыше 130 видов. Из домашних птиц чаще болеют утки, индейки, гуси, реже — куры, голуби (орнитоз).
Лабораторная диагностика хламидиозов основана на результатах бактериологического и серологического исследований.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой и люминесцентной микроскопии, выделение чистой культуры методом биопробы и идентификацию возбудителя по морфологическим свойствам.
Материал для исследования. От павших или вынужденно убитых животных в лабораторию направляют кусочки паренхиматозных органов; при аборте — плод целиком или паренхиматозные органы и сычуг; для прижизненной диагностики — пробы эякулята или замороженной спермы, кровь для серологических исследований. Материал берут в течение двух часов после гибели, убоя или аборта, помещают в термос со льдом.
Микроскопия препаратов из исходного материала. Для световой микроскопии мазки из материала окрашивают по Романовскому—Гимзе (хламидии в зависимости от стадии развития окрашены в красно- или сине-фиолетовый цвет), Стемпу. При окраске по Стемпу препараты фиксируют нагреванием, окрашивают фуксином Циля, разведенным дистиллированной водой в соотношении 1 : 5 (рН 7,4) 15 мин, промывают дистиллированной водой, обрабатывают 0,05%-м раствором серной кислоты 1 мин, вновь промывают дистиллированной водой, докрашивают 1%-м водным раствором малахитовой зелени 30 с, после чего промывают водой и микроскопируют: хламидии ярко-красные на зеленоватом фоне клеток. При иммунофлуоресцентном выявлении хламидии в материале используют прямой и непрямой варианты. В зависимости от этапа морфогенеза размеры хламидий варьируют от 0,2...0,4 до 0,6... 1,5 мкм.
Выделение и идентификация культуры возбудителя. Для выделения хламидий используют 6...7-дневные куриные эмбрионы или лабораторных животных. Из материала готовят суспензию на физиологическом растворе (1 : 10), центрифугируют, надосадочную жидкость обрабатывают антибиотиками (100ЕД/мл пенициллина, 500ЕД/мл стрептомицина) при 4 ºС 24 ч, одновременно контролируя на стерильность. Затем исследуемый материал в объеме 0,2 мл вводят в желточный мешок. Эмбрионы инкубируют в термостате при 37 °С и относительной влажности 75 %. Эмбрионы, погибшие на 4... 12-й день, вскрывают, аллантоисную жидкость контролируют на бактериальную контаминацию. Из желточных мешков готовят мазки-отпечатки и исследуют на наличие хламидий методом микроскопии. При отсутствии специфической гибели эмбрионы на 12-е сутки вскрывают и проводят второй пассаж, при необходимости — и третий.
Биопроба. Для выделения хламидий на лабораторных животных заражают пять белых мышей или две-три морские свинки. Материал, подготовленный ранее описанным способом, вводят внутрибрюшинно или интраторакально мышам по 0,3 мл, морским свинкам — по 0,5 мл. Наблюдение ведут в течение 10сут. В положительных случаях животные погибают на 7... 10-е сутки. При вскрытии обнаруживают большое количество серозно-фибринозного экссудата в грудной и брюшной полостях, очаговую пневмонию, кровоизлияния под легочной плеврой. При отсутствии гибели животных проводят слепые пассажи. Обнаружение и идентификацию хламидий проводят, как описано ранее.
Серологическая диагностика основана на результатах РСК или РДСК. Сыворотки исследуют в разведении 1 : 5 и 1:10, положительным считают задержку гемолиза на два — четыре креста в разведении 1:10, сомнительным — на один крест в разведении 1: 10 и на один — четыре креста в разведении 1:5.
Биопрепараты. Инактивированная эмульгированная вакцина против хламидиозного аборта овец.
Набор антигенов и сывороток для серологической диагностики хламидиозов сельскохозяйственных животных.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Описать характер роста микоплазм на плотных и жидких питательных средах.
2. Промикроскопировать окрашенные препараты из культур микоплазм.
3. Окрасить и промикроскопировать мазки-отпечатки, содержащие хламидии.
4. Ознакомиться с биопрепаратами.
Контрольные вопросы
1. Каковы морфологические, тинкториальные и культуральные свойства микоплазм?
2. В чем заключается бактериологическая диагностика микоплазмозов?
3. На чем основана серологическая диагностика микоплазмозов?
4. Как классифицируют хламидии?
5. Какие методы применяют для лабораторной диагностики риккетсиозов и
хламидиозов?
Тема 37
Дата добавления: 2016-07-22; просмотров: 3064;











