ЛАБОРАТОРНАЯ ДИАГНОСТИКА ЛЕПТОСПИРОЗА, КАМПИЛОБАКТЕРИОЗА И ДИЗЕНТЕРИИ СВИНЕЙ. БИОПРЕПАРАТЫ
Цель занятия. Ознакомить студентов с методами лабораторной диагностики лептоспироза, кампилобактериоза и дизентерии свиней, биологическими свойствами возбудителей, биопрепаратами.
Оборудование и материалы. Пробирки с культурой лептоспир, предметные и покровные стекла, стерильные пастеровские пипетки, мерные пипетки на 1...2мл, резиновые груши, спирт, микроскопы с темнопольными конденсорами, осветители ОИ-19, пробирки со стерильной дистиллированной водой и физиологическим раствором, пластины из плексигласа с лунками или чистые пробирки в штативах, лептоспирозные агглютинирующие сыворотки, антигены для диагностики лептоспироза в РМА, для демонстрации — пробирки с культурой лептоспир (L.bijlexa), таблицы, мазки для люминесцентной микроскопии, МЛ-2, нефлуоресцирующее масло, культуры кампилобактерий в полужидкой среде, среде Китта—Тароцци и на плотной среде, неокрашенные мазки с кампилобактериями, таблицы, биопрепараты.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Лептоспироз. Инфекционное природно-очаговое заболевание животных — свиней, крупного рогатого скота, лошадей, овец, коз, оленей, собак, верблюдов, пушных зверей, грызунов, сумчатых и др. Болеет и человек. Птицы к лептоспирозу невосприимчивы.
У животных болезнь протекает, как правило, бессимптомно, типичные клинические проявления: кратковременная лихорадка, желтуха, геморрагия, гемоглобинурия, аборты.
Возбудитель лептоспироза отнесен к роду Leptospira, который включает в себя два вида: L. interrogans— патогенные лептоспиры и L. biflexa — лептоспиры, обитающие во влажной почве и пресных поверхностных водах. Вид патогенных лептоспир представлен 183 сероварами, которые по степени антигенного родства объединены в 25 серологических групп. Основными возбудителями лептоспироза у сельскохозяйственных животных считают лептоспиры серогрупп Canicola, Grippotyphosa, Hebdomadis, Pomona, Tarassowi, Icterohaemorrhagiae.
Лабораторная диагностика лептоспироза основана на результатах бактериологического и серологических исследований.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой и люминесцентной микроскопии, выделение чистой культуры посевом на питательные среды и методом биопробы и идентификацию возбудителя по культурально-морфологическим серологическим и патогенным свойствам. Материал для исследования. Кровь берут в период лихорадки на 1...7-е сутки болезни; мочу собирают при естественном мочеиспускании в стерильные пробирки. У коров и свиноматок допустимо брать мочу катетером. Абортированный плод доставляют в лабораторию целиком или берут от него желудок с содержимым, сердце, мочевой пузырь, паренхиматозные органы. От трупов крупных животных направляют на исследование сердце, кусочки паренхиматозных органов, почку целиком, транссудат из грудной и брюшной полостей, перикардиальную жидкость, мочевой пузырь с содержимым, спинномозговую жидкость. Трупы мелких животных доставляют в лабораторию целиком.
Пробы материала должны быть исследованы в летнее время в течение 6ч с момента взятия и 10...12ч при хранении материала в охлажденном состоянии; мочу исследуют при температуре 30...40°С в течение 3 ч, при 25...30 °С - 4...5 ч, при 20...25 °С-6...8 ч, при 16...20°С — в течение 10... 12 ч с момента взятия.
Для бактериологического исследования материал предварительно следует подготовить: мочу центрифугируют (при 10 000... 15 000 мин-1 30 мин), исследуют осадок; из проб органов готовят суспензию в стерильном физиологическом растворе, исследуют в нативном состоянии или после центрифугирования.
Микроскопия препаратов из исходного материала. Лептоспиры разных сероваров не различаются по морфологическим и культу-ральным признакам. Длина лептоспир колеблется от 3 до 30 мкм и более, в среднем 7...15 мкм, ширина 0,06...0,15 мкм. Лептоспиры — грамотрицательные бактерии. Поскольку они плохо воспринимают окраску, их обычно исследуют в неокрашенном состоянии. Готовят препарат «раздавленная капля» и изучают методом темнопольной микроскопии при увеличении 40 x 7...10 или 20 х 1,5 х 10, а для более детального изучения — при увеличении 40x10...15 или 40 x 1,5 x 10. В каждой капле просматривают не менее 50 полей зрения. Лептоспиры представляют собой спиралевидные тонкие серебристые нити, концы которых — один или оба — загнуты в виде крючков (рис. 109).
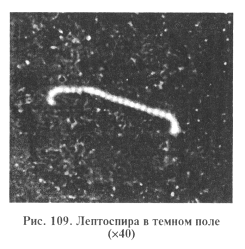
Лептоспиры подвижны. Формы движения: вращательное, прямолинейное, поступательное с одновременным вращением вокруг собственной оси и круговое.
Для люминесцентной микроскопии готовят мазки из того же материала и обрабатывают их флуоресцирующим глобулином для диагностики лептоспироза.
Выделение и идентификация культуры возбудителя. Лептоспиры - факультативные анаэробы, температурный оптимум 28...30°С. Для получения культуры лептоспир исследуемый
материал высевают пастеровской пипеткой по три - пять капель в 5...7 пробирок со специальной питательной жидкой или полужидкой средой. Посевы культивируют при 28...30 °С в течение трех месяцев. Обычно рост лептоспир появляется в течение 7...20 сут, иногда их обнаруживают на 3...5-е сутки или через 1...2мес и очень редко — через 2,5...З мес культивирования.
Для выявления роста лептоспир через 3, 5, 7, 10 сут и далее каждые 5 сут культивирования из всех пробирок готовят препарат «раздавленная капля» для исследования методом темнопольной микроскопии.
Макроскопически рост лептоспир выражен слабо. При достаточном накоплении лептоспир после встряхивания пробирки с культурой в среде в проходящем свете заметны муаровые волны, а в спокойном состоянии отмечают легкую опалесценцию. Наличие пленки, осадка, помутнения среды свидетельствуют о присутствии посторонней микрофлоры, а полная прозрачность среды — об отсутствии роста лептоспир.
Для культивирования лептоспир используют следующие питательные среды.
Среда Ферворта—Вольфа (в модификации С. И. Тарасова): к 900 мл дистиллированной воды добавляют 0,5 г хлорида натрия, 1 г пептона (Дифко), 100 мл маточного раствора фосфатного буфера рН 7,2...7,4. Смесь автоклавируют в колбе при 120 ºС 30 мин. На следующий день дважды фильтруют через бумажный фильтр, разливают в пробирки по 5 мл и вновь автоклавируют при 120 °С 30 мин. В пробирки добавляют по 0,5 мл кроличьей сыворотки и прогревают среду на водяной бане при 56...58 ºС 30 мин.
Среда Любашенко: нехлорированную водопроводную (или колодезную, речную) воду, профильтрованную через бумажный фильтр, стерилизуют в автоклаве при 1 атм 30 мин, охлаждают, устанавливают рН 7,3...7,4, добавляют 5 % кроличьей или бараньей сыворотки, прогретой при 56 ºС в течение 1 ч. Затем среду пропускают через фильтрующие пластины СФ в фильтре Зейтца и асептически разливают в пробирки. Для контроля стерильности среды пробирки помещают в термостат при 37 °С на 48 ч.
Можно применять и другие питательные cpeды. На плотных средах (Кокса, ВГНКИ и др.) лептоспиры образуют мелкие колонии в виде прозрачных дисков диаметром до 1...2см с хорошо очерченными или размытыми краями или в виде матовых точек диаметром 1...2 мм.
Для серологической идентификации выделенную чистую культуру исследуют в РМА с групповыми агглютинирующими лептоспирозными сыворотками, предварительно разведенными стерильным физиологическим раствором в соотношении 1 : 50, 1 : 500, 1 : 1000, 1 : 2000, 1 : 4000, 1 : 8000, 1 : 16 000 и 1 : 32 000. Реакцию ставят в агглютинационных пластинах (или в пробирках), смешивая 0,1мл сыворотки каждого разведения с 0,1мл выделенной (типируемой) 5-, 7-, 10-суточной культуры лептоспир с накоплением 70...100 подвижных микробных клеток. Разведения сыворотки последовательно удваиваются. Пластины (пробирки) выдерживают в термостате при 37 °С 1 ч, затем учитывают результаты — из каждой лунки (начиная с наибольшего разведения) готовят препараты «раздавленная капля», которые исследуют методом темнопольной микроскопии. Реакцию оценивают в крестах: (++++) — 100%-я агглютинация: склеивание лептоспир с образованием скоплений в виде «паучков» (рис. 110), содержащих от нескольких клеток до нескольких десятков и даже сотен; свободные концы клеток сохраняют подвижность; (+++) — агглютинировано 75% лептоспир; (++) —50%; (+) — агглютинировано 25%; (-) —агглютинация отсутствует. РМА считают положительной, если она выражена на четыре, три и два креста. Исследуемую культуру относят к той серологической группе лептоспир, с сывороткой которой она дает реакцию на два...четыре креста до 50...100 % ее титра, указанного на этикетке.

Рис. 110. Реакция микроагглютинации: «паучки» из склеившихся лептоспир
Биопроба. Метод используют для выделения культуры возбу-дителя из исследуемого материала, так как посевом на питательные среды изолировать лептоспиры удается не всегда, а также для установления патогенных свойств чистых культур. Биопробу ставят на золотистых хомячках 20...30-дневного возраста, крольчатах-сосунках в возрасте 10...20 дней и 3...5-недельных морских свинках. Исследуемый материал (кровь, моча, суспензия из паренхиматозных органов или абортированного плода и др.) вводят подкожно или внутрибрюшинно хомякам от 0,3...0,5 до 1 мл, крольчатам — 2...3 мл. На каждую пробу материала берут по 2 животных, одного из которых убивают на 4...5-й день в период подъема температуры, другого, если животное не погибает,— на 14...16-й день после заражения. Кровь последнего исследуют в реакции микроагглютинации (РМА), начиная с разведения 1: 10, с лептоспирами 13 серологических групп.
Высевы из органов убитых и павших животных (сердца, печени и почек) делают в 2...3 пробирки из каждого органа. Транссудат из грудной и брюшной полостей, перикардиальную жидкость, содержимое мочевого пузыря исследуют методом темнопольной микроскопии.
Вирулентность выделенной культуры определяют на золотистых хомячках или крольчатах, которых заражают внутрибрюшинно 5...7-дневной культурой, содержащей 70... 100 лептоспир в поле зрения микроскопа. Высоковирулентные культуры лептоспир вызывают гибель золотистых хомячков в дозе менее 0,1 мл, средней вирулентности — 0,2...0,4 мл, слабовирулентные — 0,5... 1 мл.
Серологическая диагностика включает в себя постановку реакции микроагглютинации (в качестве антагена используют живые культуры лептоспир определенных серологических групп) и реакции макроагглютинации (применяют концентрированную взвесь лептоспир).
В реакции микроагглютинации сыворотки крови исследуют в разведениях 1:50, 1:250, 1:1250.
Учет реакции: каплю из каждой лунки исследуют методом темнопольной микроскопии при увеличении 20x10 или 20x7x1,5. Агглютинация проявляется в образовании «паучков», содержащих от 3...5 до нескольких десятков лептоспир.
Специфические антитела в сыворотке крови животных в титре 1:50... 1:100 и выше свидетельствуют об инфицированности данной особи лептоспирами и возможном лептоспироносительстве.
По результатам серологических исследований диагноз на лептоспироз считают установленным, а хозяйство неблагополучным по лептоспирозу, если специфические антитела обнаружены в сыворотке крови при однократном исследовании в РМА в титре 1:100 и выше более чем у 25 % обследованных животных, а также при нарастании титра антител в 5 раз и более при повторном исследовании через 7...10 дней сыворотки крови в РМА или при обнаружении антител у ранее нереагировавших животных.
Сыворотки животных, дающие положительную реакцию микроагглютинации в равных титрах с лептоспирами нескольких серологических групп или дающие наиболее высокий титр с лептоспирами, ранее неизвестными в качестве возбудителя лептоспироза сельскохозяйственных животных, исследуют в реакции иммуноадсорбции.
Для постановки реакции иммуноадсорбции все штаммы лептоспир, с которыми данная сыворотка дала положительную реакцию микроагглютинации, выращивают в 0,5...1-литровых флаконах в течение 5...7 сут. Затем культуры лептоспир осаждают центрифугированием при
10 000 мин-1 30 мин. Надосадочную жидкость сливают, а осадок суспендируют в 0,9 мл питательной среды или физиологического раствора. 0,1 мл исследуемой сыворотки смешивают с 0,9 мл концентрированного антигена и выдерживают в течение 48 ч при 1...5 ºС. Отделяют сыворотку центрифугированием при 10 000 мин-1 30 мин. Адсорбированную сыворотку проверяют в реакции микроагглютинации на наличие остаточных антител к штамму-адсорбенту, а затем исследуют с лептоспирами всех групп, с которыми сыворотка дала положительную реакцию до адсорбции. В результате адсорбции лептоспиры, являющиеся возбудителем, удаляют из сыворотки антитела к лептоспирам всех других серологических групп; гетерологичные типы лептоспир не адсорбируют антитела к штамму-возбудителю.
Реакцию макроагглютинации ставят на стекле, на которое наносят каплю исследуемой сыворотки крови, разведенной в соотношении 1 : 100, и равное количество антигена, компоненты перемешивают, результат учитывают в проходящем свете. Положительным результатом считают агглютинацию интенсивностью на два креста и выше, сомнительным — на один крест.
Антитела в крови можно обнаружить также методом иммуноферментного анализа.
Биопрепараты. Депонированная поливалентная вакцина против лептоспироза животных ВГНКИ содержит шесть штаммов лептоспир с наиболее выраженными антигенными и иммуногенными свойствами, относящихся к серогруппам Pomona, Tarassovi, Icterohaemorrhagiae, Canikola, Grippotyphosa, Hebdomadis. Выращенные культуры лептоспир сливают в общую емкость, инактивируют, концентрируют, добавляют адъювант. Вакцину проверяют на стерильность, безвредность и активность (на кроликах).
Поливалентную вакцину против лептоспироза сельскохозяйственных и промысловых животных готовят из 7... 10-дневной культуры лептоспир, консервированных 5%-м раствором карболовой кислоты до конечного содержания фенола в вакцине 0,5 %. Вакцину контролируют на стерильность, безвредность и активность (на кроликах).
Поливалентную сыворотку против лептоспироза сельскохозяйственных и промысловых животных получают методом гипериммунизации волов-продуцентов. Антигены для гипериммунизации готовят из производственных штаммов шести серогрупп. Сыворотку консервируют 5%-м раствором фенола, проверяют на стерильность, безвредность (на белых мышах и морских свинках) и активность (в реакции микроагглютинации в разведениях от 1:1000 до 1 : 100 000).
Антигены для диагностики лептоспироза реакцией макроагглютинации готовят из эталонных штаммов лептоспир. Выращенные культуры инактивируют формалином, концентрируют, расфасовывают по ампулам и подвергают сублимационному высушиванию. Антигены контролируют на растворимость в физиологическом растворе, на концентрацию. Активность антигена проверяют в РА на стекле с гомологичной лептоспирозной агглютинирующей сывороткой.
Групповые агглютинирующие лептоспирозные сыворотки предназначены для определения серогрупповой принадлежности лептоспир, выделенных из патологического материала, а также лептоспир, используемых в качестве антигенов в реакции микроагглютинации при серологической диагностике лептоспироза.
Кампилобактериоз (вибриоз). Хроническое заболевание крупного рогатого скота, овец, свиней, которое проявляется абортами, задержанием последа, временным бесплодием, вагинитами, метритами, рождением нежизнеспособного потомства. У кур возбудитель вызывает падеж цыплят, снижение яйценоскости несушек и прироста массы у бройлеров, у людей — гастроэнтериты, бактериемию, кожные поражения.
Возбудитель кампилобактериоза — бактерии семейства Spirillaceae, род Campylobacter. Основные виды: С. fetus (подвиды С. fetus venerealis и С. fetus fetus), С. jejuni, С. sputorum (подвиды С. sputorum sputorum, С. sputorum bubulus, С. sputorum faecalis) и непатогенный С. coli (табл. 33). С. fetus sb. fetus вызывает аборты у овец, крупного рогатого скота. С.fetus sb. veneralis — патогенен для крупного рогатого скота. С. jejuni вызывает аборты у овец, энтериты у телят, ягнят и других животных. С. mucosalis патогенен для свиней, его выделяют от животных с признаками некротического энтерита, локального илеита.


Лабораторная диагностика кампилобактериоза основана на результатах бактериологического и серологического исследований.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим, ферментативным, серологическим свойствам.
Материал для исследования. В лабораторию направляют абортированный плод (целиком с плодными оболочками или от крупных плодов голову, желудок, легкие, печень); плаценту; слизь из шейки матки, взятую стерильно в первые 3...4 дня после аборта или в период охоты; от быков-производителей — препуциальную слизь и секрет придаточных половых желез; от убитых с диагностической целью животных — матку, влагалище, лимфоузлы тазовой области.
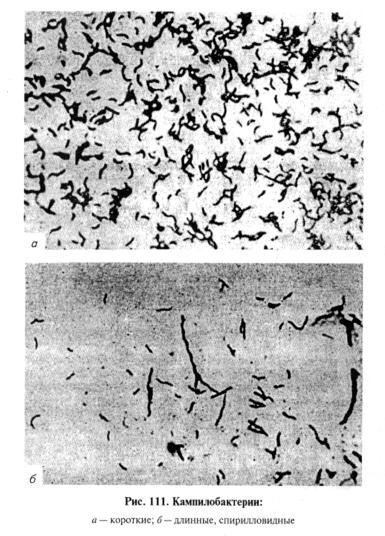
Микроскопия препаратов из исходного материала. Представители рода Campylobacter — грамотрицательные, полиморфные, тонкие палочки, изогнутые в виде «крыла чайки», запятой, спирали с одним или несколькими завитками или S-образные. Средние размеры (0,5...8) х (0,2...0,8) мкм. Подвижны за счет одного полярного жгутика на одном или обоих концах клетки, движение винтообразное; спор и капсул не образуют (рис. 111).
В мазках из патологического материала кампилобактерии обнаруживают в виде «крыла чайки», запятой или S-образной формы; от животных, подвергавшихся лечению, — в виде длинных спирилл, малоизвитых нитей и мелких кокковидных форм.
Выделение и идентификация культуры возбудителя. Возбудитель — микроаэрофил, температурный оптимум 37...38 °С. Для получения культуры кампилобактерии используют полужидкие и плотные питательные среды: плотный 2...3%-й МППА и полужидкий 0,2%-й мясо-печеночный пептонный агар (ПЖА), среду Китта—Тароцци без масла, агар Мартена, сафранино-железо-новобиоциновую (СЖН) среду. Для обогащения в питательные среды добавляют 5... 10 % дефибринированной крови крупного рогатого скота, овец, кроликов или сыворотку крови лошади. Культивируют в течение 6...10 сут в микроаэрофильных условиях при замене 10...15% воздуха оксидом углерода (IV). Контаминированный материал высевают на среду СЖН: полужидкий агар — 985 мл, 2%-й раствор сульфата железа — 5 мл, 0,5%-й водный раствор сафранина Т — 5 мл и 0,2%-й водный раствор новобиоци-на — 5 мл. Среду фильтруют через бумажный фильтр, разливают в пробирки и автоклавируют при 115°С 25 мин. Готовая к использованию среда должна быть розового цвета, рН 6,8. При культивировании на данной среде кампилобактерии ее цвет не изменяется, другой микрофлоры — приобретает ярко-желтую окраску.
Каждую пробу высевают на несколько чашек Петри, растирая шпателем по поверхности среды. Выросшие колонии пересевают на полужидкий кровяной, сывороточный агар или среду Китта— Тароцци для получения чистой культуры.
При первичном выделении на плотной среде кампилобактерии образуют через 3...4 сут колонии: гладкие, бесцветные, диаметром 1 мм или шероховатые, непрозрачные, белые или кремовые до 2 мм в диаметре, могут быть плоские, серые или светло-коричневые с неровными краями, редко растут в виде тонкого налета. На кровяном агаре гемолиза не дают. При росте на сывороточном бульоне дают слабое помутнение, иногда с образованием незначительного рыхлого осадка, на полужидком агаре растут в виде серовато-голубого диска около поверхности среды.
У выделенных культур кампилобактерии изучают ферментативную активность, ростовые потребности и на основании полученных данных идентифицируют их на уровне вида, подвида, биовара (см. табл. 33).
Для серологической идентификации кампилобактерии выпускают агглютинирующие и люминесцирующие сыворотки против С. fetus subsp. fetus (так называемый Первый тип), С. fetus subsp. venerealis (Второй тип), С. sputorum subsp. bubulus (Третий тип).
Для ориентировочной идентификации выделенных культур ставят РА на стекле, используя указанные сыворотки, разведенные 1:50.
Для окончательной серологической идентификации кампилобактерии ставят пробирочную РА: готовят последовательные разведения каждой из трех моноспецифических сывороток в 3%-м растворе хлорида натрия, содержащем 0,3 % формалина, — 1 : 25, 1 : 50, 1 : 100, 1 : 200. Затем в каждую пробирку с указанными разведениями моноспецифических сывороток добавляют по 0,5 мл исследуемой суспензии вибрионов (концентрация 1 • 109).
После внесения компонентов пробирки тщательно встряхивают и помещают в термостат при 37 ºС до следующего дня. Затем их выдерживают З...4ч при комнатной температуре и учитывают результаты реакции.
При положительной реакции с моноспецифической сывороткой одного типа и отрицательной— с моноспецифическими сыворотками остальных двух типов исследуемый штамм относят к тому типу, с которым получен положительный результат.
При получении положительной реакции с двумя моноспецифическими сыворотками (что может быть при выделении атипичных или диссоциированных штаммов) опыт повторяют с обеими моноспецифическими сыворотками, агглютинировавшими исследуемую суспензию вибрионов, применяя более высокие разведения, чтобы определить титр каждой сыворотки. Типовую принадлежность исследуемого штамма устанавливают по той моноспецифической сыворотке, которая агглютинирует микробную суспензию в более высоком титре.
Для идентификации возбудителей кампилобактериоза в реакции иммунофлуоресценции используют как чистые, так и смешанные культуры, выращенные на общепринятых питательных средах.
Биопроба. Нативным материалом или выделенной культурой заражают беременных морских свинок внутрибрюшинно или во влагалище с последующим исследованием абортированных плодов. Если в течение 10... 12 сут аборта не наступает, морских свинок убивают и исследуют содержимое полости матки и плоды. При необходимости биопробу ставят на беременных телках и овцах, заражая их подкожно или перорально. Животные абортируют, при отсутствии аборта их убивают с диагностической целью.
Серологическая диагностика кампилобактериоза у коров основана на результатах реакции агглютинации с вагинальной слизью (РАВС), а у овец — РА с сывороткой крови.
Слизь берут марлевым тампоном, который помещают в пробирку с 5 мл формалинизированного 3%-го раствора хлорида натрия. Выдерживают при температуре 1...4°С 12...14ч. Тампон отжимают, жидкость центрифугируют при 2500...3000 мин-1 30 мин.
После центрифугирования реакцию ставят с экстрактом вагинальной слизи в четырех разведениях (табл. 34). Для приготовления кампилобактериозного антигена исходную концентрированную суспензию бактерий разводят физиологическим раствором, содержащим 0,3 % формалина, в соотношении 1 : 10.
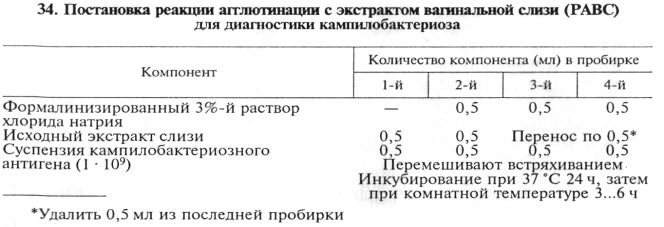
Наряду с исследуемыми пробами материала ставят контроли антигена: 1) контроль антигена (проверка самоагглютинации): в пробирку наливают 0,5 мл антигена в рабочем разведении и добавляют 0,5 мл 3%-го формалинизированного раствора хлорида натрия; 2) контроль активности антигена: в каждую пробирку с разведенной агглютинирующей кампилобактериозной сывороткой Первого типа добавляют по 0,5 мл антигена; 3) контроль специфичности антигена: в две пробирки, содержащие по 0,5 мл нормальной сыворотки в разведениях 1 : 100 и 1 : 200, добавляют по 0,5 мл антигена. Все пробирки встряхивают и далее поступают с ними так же, как с опытными.
Вначале учитывают результаты контроля антигена. Отрицательная реакция в первом и третьем контролях при положительной во втором свидетельствует о правильности постановки реакции.
Учет результатов: 1) положительная — реакция хорошо выражена (на три-четыре креста) во всех пробирках или только в 1-й и 2-й; 2) сомнительная — агглютинация на один-два креста в 1-й и во 2-й пробирках; 3) отрицательная — отсутствие агглютинации во всех пробирках.
У больных овец для исследования берут сыворотку крови, разводят ее в 100, 200 и 400 раз. Результат считают положительным, если исследуемая сыворотка дает положительную реакцию агглютинации в разведении 1 : 200 и выше на четыре или три креста, сомнительным — на четыре или три креста в разведении 1 :100 либо на два или один крест в разведении 1:200, отрицательным — если агглютинация отсутствует или ее оценивают не выше чем на два или один крест в разведении 1 : 100. Сыворотку овец, вакцинированных против кампилобактериоза, серологически не исследуют.
Кроме реакции агглютинации сыворотку животных можно исследовать в РСК, реакции иммунофлуоресценции или реакции иммунной сорбции антител, меченных ферментами. Разработаны экспериментальные партии диагностикумов для выявления антител в РНГА, пригодные для диагностики кампилобактериозов животных и человека.
Биопрепараты. Эмульсинвакцина инактивированная против кампилобактериоза овец.
Кампилобактериозные агглютинирующие сыворотки готовят методом гипериммунизации кроликов суспензией живых микробов кампилобактерии. Полученные сыворотки после адсорбции групповых антител проверяют на активность, специфичность и стерильность.
Кампилобактериозный антиген представляет собой инактивированную 0,3%-м раствором формалина суспензию кампилобактерии Первого типа (концентрация микробных клеток 1010/мл). Предназначен для диагностики кампилобактериоза у крупного рогатого скота.
Дизентерия свиней. Инфекционная болезнь. Характеризуется геморрагическим поносом и некротическим поражением толстого отдела-кишечника. Восприимчивы свиньи всех возрастов, но чаще болеет молодняк в возрасте 1...6мес.
Возбудитель дизентерии свиней — спирохета Serpulina hyodysenteriae, род Serpulina.
Лабораторная диагностика дизентерии свиней основана на результатах бактериологического исследования.
Бактериологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии (основной метод), а также выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим и ферментативным свойствам.
Материал для исследования. Для прижизненной диагностики в лабораторию направляют фекалии, для посмертной — слизистую оболочку большой ободочной кишки, которую соскабливают после удаления из кишечника содержимого и промывания водой. От трупов материал берут не позднее чем через 2 ч после гибели животного, материал должен быть исследован в течение 2...4 ч, а при хранении на холоде — 6...8 ч.
Микроскопия препаратов из исходного материала. Поскольку культивирование возбудителя весьма трудоемко, микроскопическое исследование — это основной метод диагностики, доступный практическим лабораториям. Поступивший материал исследуют методом темнопольной, фазово-контрастной или обычной световой микроскопии.
При темнопольной микроскопии препарат «раздавленная капля» исследуют в водной иммерсии с объективом х 40 и окулярами х 7 или х 10. Возбудитель в этом случае виден как спиралевидная клетка с 3...12 правильными витками размером (7...9) х (0,3...0,4) мкм, движущаяся змеевидно-поступательно. При температуре 22 °С наблюдают изгибание и скользящее движение клетки, а при 37...42 ºС клетка движется поступательно. У большинства больных дизентерией свиней в препарате «раздавленная капля» в одном поле зрения обнаруживают 5... 10 спирохет и более. В окрашенных по Граму препаратах видны грамотрицательные извитые клетки со строением, типичным для спирохет. Клетки возбудителя хорошо окрашиваются по Романовскому—Гимзе, фуксином Пфейффера. Сходные по морфологии с Serpulina hyodysenteriae вибрионы, обитающие в кишечнике, отличаются тем, что их клетка в 2...4 раза толще, с тупыми концами, движение вращательное вокруг длинной оси.
Выделение и идентификация культуры возбудителя. Возбудитель—строгий анаэроб, температурный оптимум 36...38 ºС, при 25 и 30 °С не растет, рН 7,0...7,2. Для первичной изоляции используют селективные среды, например следующие.
Кровяной агар со спектомицином: к перевару Хоттингера добавляют 0,001 % резазурина (индикатор ОКВП), 0,5 % хлорида натрия, 0,25 % глюкозы, 1 % пептона, 2 % агара, кипятят, пропускают через среду азот или оксид углерода (IV) в течение 10... 15 мин, устанавливают рН 7,0...7,2, вносят 0,05 % гидрохлорида цистеина. Среду автоклавируют при 110º С 30 мин, охлаждают до 40...45°С, пропуская при этом через среду стерильный обескислороженный газ, после чего вносят 10% дефибринированной крови барана (или крупного рогатого скота) и 400 мкг/мл спектомицина. Среду разливают в атмосфере оксида углерода (IV).
Культивируют также в жидкой или полужидкой среде, содержащей сердечно-мозговую вытяжку и 10 % эмбриональной телячьей или кроличьей сыворотки. На кровяном агаре через 48...96ч инкубирования при 38 °С вырастают плоские просвечивающие колонии диаметром 0,5...3 мм с зоной бета-гемолиза. В полужидком сывороточном агаре возбудитель растет в виде беловатого диффузного облачка ближе к поверхности среды.
После изучения морфологии и культуральных свойств у выделенных бактерий исследуют ферментативную активность. Патогенные для свиней культуры гидролизуют эскулин, не ферментируют фруктозу, утилизируют пируват, при сбраживании глюкозы образуют водород, углекислоту, ацетат, бутират; нитрат не восстанавливают; растут на средах, содержащих 6,5 % хлорида натрия, но не растут на средах с 1 % глицина.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Из чистой культуры лептоспир приготовить препараты «раздавленная капля» и изучить их методом темнопольной микроскопии.
2. Поставить РМА с культурой лептоспир и двумя сыворотками различных антигенных групп в пробирках или на пластинах, учесть результат реакции, начиная с наибольшего разведения сыворотки. Из пробирки (лунки) каждого разведения сыворотки приготовить препарат «раздавленная капля» и изучить методом темнопольной микроскопии.
3. Окрасить мазки с кампилобактериями по Граму, промикроскопировать, зарисовать.
4. Изучить характер роста кампилобактерии на питательных средах и сделать заключение о морфологических и тинкториаль-ных свойствах возбудителя.
Контрольные вопросы
1. В чем заключаются особенности микроскопирования лептоспир?
2. Каковы морфологические и культуральные свойства лептоспир?
3. Каковы правила взятия патологического материала для исследования на лептоспироз?
4. Какие методы применяют для серологической диагностики лептоспироза?
5. Как ставят биопробу при лептоспирозе?
6. Каковы морфологические и тинкториальные свойства возбудителя кампилобактериоза?
7. В чем состоит серологическая диагностика кампилобактериоза?
8. Каковы морфологические особенности возбудителя дизентерии свиней?
Тема 36
Дата добавления: 2016-07-22; просмотров: 3283;











