МИКОЗОВ, ВЫЗЫВАЕМЫХ ПЛЕСНЕВЫМИ И ДРОЖЖЕПОДОБНЫМИ ГРИБАМИ. БИОПРЕПАРАТЫ
Цель занятия. Ознакомить студентов со свойствами возбудителей, методами микологического исследования и этапами лабораторной диагностики трихофитии, микроспории, аспергиллеза, пенициллиоза, мукоромикоза, кандидамикоза, эпизоотического лимфангита, кокцидиоидомикоза.
Оборудование и материалы. Материал от животных, пораженных трихофитией и микроспорией, культуры грибов рода Мисог, Aspergillus, Candida на плотной питательной среде Сабуро или др., препаровальные иглы, микологические крючки, предметные и покровные стекла, смесь воды, спирта, глицерина (поровну), 20%-й раствор гидроксида натрия или гидроксида калия, 50%-й водный раствор глицерина, плакаты, таблицы, биопрепараты.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Микозы — группа болезней животных и человека, вызываемых патогенными микроскопическими грибами. Основные методы лабораторной диагностики этих болезней: микроскопия, выделение и идентификация грибов-возбудителей.
Дерматомикозы. Заболевания кожи и ее производных. Восприимчивы сельскохозяйственные животные всех видов (преимущественно молодняк), пушные и хищные звери. У людей инфицированию более подвержены дети. Важным фактором заражения служит мацерация кожи.
Возбудители дерматомикозов — грибы дерматофиты, принадлежат к высшим, несовершенным (класс Deuteromycetes) грибам, широко распространены в природе. Они паразитируют на ороговевших субстратах, выделяя кератиназу, разлагающую кератин эпидермиса, волос, ногтей. К дерматофитам относят представителей трех родов: Trichophyton, Microsporum, Epidermophyton (более 40 видов). В быту трихофитию и микроспорию называют «стригущий лишай».
Трихофития. Инфекционное заболевание. Характеризуется появлением на коже округлых или овальных облысевших очагов с мягкими, иногда сухими корочками в области головы. Поражения могут распространяться по поверхности тела животного (рис. 117, 118).

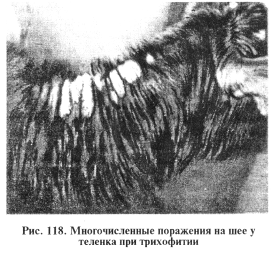
При поверхностной форме размер повреждений 1...5см в диаметре, иногда развиваются более обширные очаги. Корки легко отделяются вместе со склеенными волосами, под ними на слегка влажной поверхности кожи торчат обломавшиеся волосы, кое-где встречаются папулы и пузырьки.
При глубокой форме болезни наблюдают несколько очагов поражения с ярко выраженными экссудативными и воспалительными процессами, инфильтрацию, большое количество фолликулярных пустул. Встречаются множественные экссудативные поражения. Все очаги покрыты засохшим серозно-гнойным экссудатом. При удалении корок обнаруживают эрозии. Часто отмечают осложнения секундарной инфекцией.
Основные возбудители трихофитии: у крупного рогатого скота, буйволов, зебу, оленей — Т. verrucosum (син. Т. faviforme), реже Т. mentagrophytes; у лошадей — Т. equinum и Т. mentagrophytes; у овец и коз — Т. verrucosum, Т. mentagrophytes; у свиней — Т. mentagrophytes; у верблюдов — Т. verrucosum, Т. sarkisovi; у собак и кошек — Т. mentagrophytes (кошки редко болеют трихофитией); у пушных зверей и кроликов — Т. mentagrophytes, редко Т. verrucosum; у лабораторных животных (мыши, крысы, хомяки, морские свинки) — Т. mentagrophytes; у птиц — Т. gallinae. Этот возбудитель известен давно как возбудитель парши (фавуса) преимущественно у рода куриных. Раньше болезнь называли «белый гребень».
Микроспория. Инфекционное заболевание кожи и ее производных. Появление очагов поражения сопровождается воспалительным процессом, обламыванием и выпадением волос, иногда наблюдают поражение когтей.
Основные возбудители микроспории: у кошек и собак — М. canis (син. М. lanosum); у лошадей — М. equinum, редко М. distorum и М. gypseum; у свиней — М. canis; у пушных зверей, кроликов — М. canis; у лабораторных животных — М. canis; у крупного рогатого скота и овец — М. canis и М. gypseum. Микроспорией болеют дикие звери, а также животные зоопарков и цирков.
Лабораторная диагностика трихофитии и микроспории основана на результатах микологического исследования.
Микологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии и люминесцентного анализа, выделение чистой культуры посевом на специальные питательные среды и идентификацию возбудителя по культурально-морфологическим свойствам.
Материал для исследования. В лабораторию направляют соскобы с пораженных частей тела животного вместе с корочками и чешуйками, пораженные волосы с участков, граничащих со здоровой кожей.
Микроскопия препаратов из исходного материала. Чаще готовят неокрашенные (нативные) препараты. Исследуемый материал помещают в чашки Петри, измельчают ножницами и расщепляют с помощью скальпеля. Затем кусочки волос, чешуек, корочек переносят на предметное стекло, наносят каплю 20%-го раствора гидроксида натрия или гидроксида калия и слегка подогревают над пламенем горелки до отхождения паров. После этого добавляют каплю 50%-го водного раствора глицерина. На приготовленный препарат накладывают покровное стекло и просматривают сначала под малым увеличением сухого объектива (х 8), затем с объективом х 40 или с помощью иммерсионной системы.
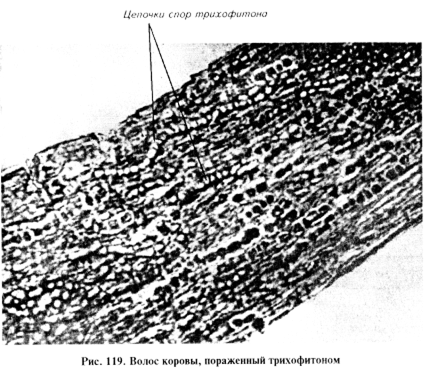
С целью дифференциации грибов рода Trichophyton и Microsporum учитывают характер расположения спор в пораженном волосе (рис. 119, 120) (цепочками или мозаичное), пользуясь следующими критериями:

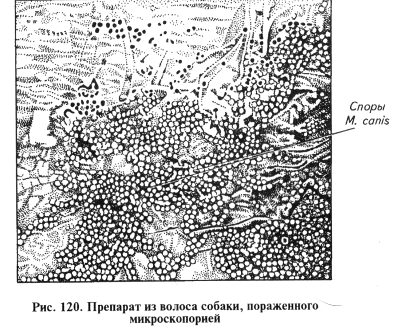
Люминесцентный анализ заключается в следующем. Исследуемый материал помещают в чашки Петри на расстоянии 20 см от ртутно-кварцевой лампы ПРК-2 или ПРК-4 с фильтром Вуда и просматривают под ультрафиолетовыми лучами в затемненном помещении. Пораженные возбудителем микроспории волосы дают яркое зеленоватое свечение. Корочки, чешуйки не светятся. Кроме того, с помощью люминесцентного анализа проводят раннюю диагностику атипичных и скрытых форм микроспории.
Обнаружение мицелия гриба и различных спор в материале — достаточное основание для постановки диагноза на дерматомикозы.
Выделение и идентификация культур возбудителей трихофитии и микроспории. Культуры выделяют в сомнительных случаях для подтверждения диагноза. Для получения чистой культуры грибов отдельные волосы или фрагменты кожи, корочки высевают на специальные питательные среды — агар Сабуро, сусло-агар, МПА, содержащий 2 % глюкозы, агар Чапека и некоторые другие. Чтобы освободить исследуемый материал от сопутствующей микрофлоры, перед посевом на питательные среды его обрабатывают 60%-м этанолом в течение 5...7 мин, а затем дважды отмывают дистиллированной водой и подсушивают в термостате при 37 °С, или же в питательные среды добавляют антибиотики (пенициллин, стрептомицин и др.) из расчета 100...200 ЕД/мл. Посевы инкубируют при температуре 26...28 °С 20...30сут и более. У выросших культур грибов изучают культуральные и морфологические свойства. Готовят препараты «раздавленная капля» (см. тему 5) и микроскопируют. При идентификации видов грибов руководствуются признаками, изложенными в таблице 35.


Биопрепараты. Препарат ТФ-130 (ВИЭВ) и сухая вакцина ЛТФ-130 (ВИЭВ) против трихофитии крупного рогатого скота содержат аттенуированный штамм Trichophyton verrucosum (faviforme).
Вакцина СП-I против трихофитии лошадей из штамма Trichophyton equinum.
Вакцина Триховис (ВИЭВ) сухая против трихофитии овец из штамма Trichophyton verrucosum (вариант автотрофикум).
Вакцину МЕНТАВАК против трихофитии пушных зверей и кроликов готовят из культуры Trichophyton mentagrophytes.
Вакцина Камелвак-ТС против трихофитии верблюдов содержит аттенуированный штамм гриба Trichophyton sarkisovi.
Вакцина МИКОЛАМ против трихофитии и микроспории плотоядных животных, нутрий и кроликов.
Поливак-ТМ — инактивированная вакцина против дермато-фитозов собак, включая 8 видов и разновидностей грибов рода Trichophyton и Microsporum.
Вакцина ВАКДЕРМ против дерматофитозов животных предназначена для борьбы с микроспорией и трихофитией собак, кошек, пушных зверей и кроликов. Готовят из высокоиммуногенных штаммов Microsporum canis, Microsporum gypseum и Trichophyton mentagrophytes.
Аспергиллез.Заболевание домашних и диких птиц, пчел, редко млекопитающих (крупный рогатый скот, овцы, козы, свиньи, лошади); восприимчив человек. Характеризуется гранулематозным поражением органов дыхания, в основном легких, нередко абортами. В легких при размножении возбудителя формируется аспергиллома. Аспергиллома (аспергиллезная мицетома) — шарообразная масса мицелия диаметром до 2 см (обычно Aspergillus fumigatus) и клеточного детрита, заполняющая полости легкого, образовавшиеся вследствие разрушения ткани. В отечественной практике этим термином обозначают любую инфекционную гранулему, вызванную видами Aspergillus.
Возбудители аспергиллеза принадлежат к высшим несовершенным грибам класса Deuteromycetes, рода Aspergillus, группе головчатых плесеней. Основные возбудители аспергиллеза животных — A. fumigatus, A.flavus, A. niger.
Лабораторная диагностика аспергиллеза основана на результатах микологического исследования.
Микологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культу-рально-морфологическим и патогенным свойствам.
Материал для исследования. В лабораторию направляют свежие трупы мелких животных, наложения, узелки, пораженные органы или их кусочки, мокроту, яйца.
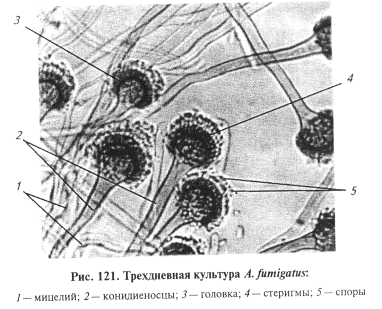
Микроскопия препаратов из исходного материала. Непосредственное обнаружение гриба в неокрашенном или окрашенном препарате имеет значение лишь для предварительного диагноза. При этом выявление характерных для аспергиллов органов плодоношения особенно ценно и значительно ускоряет лабораторную диагностику. Исследуемый материал помещают в смесь этанола с глицерином и водой поровну или в физиологический раствор. Препараты микроскопируют, как описано в теме 5, ориентируясь на обнаружение органов плодоношения (рис. 121) — головка, стеригмы со спорами (см. тему 5).
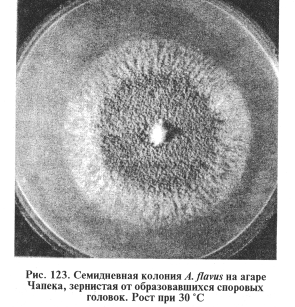
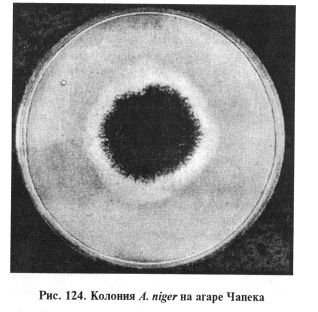
Выделение и идентификация культуры возбудителя. Для посева используют агар Чапека, Сабуро, кровяной, мозговой, кукурузный агары, МПА (рН 5,5...6,5). Гранулематозную ткань обжигают над пламенем, вырезают стерильно кусочки из середины и раскладывают их на плотную среду в чашки Петри, а экссудат засевают в пробирки со средой, инкубируют при 25 и 37 °С. На 3...5-е сутки на плотных средах образуются характерные для аспергилл колонии (рис. 122... 124).
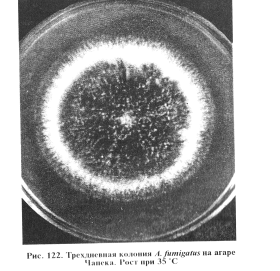
A.fumigatus на агаре Чапека образует разрастающиеся колонии — ровные или шероховатые. Развитый воздушный мицелий придает им войлочный вид белого цвета или, позднее, зеленого. Зрелые культуры в стадии спороношения черного цвета. С обратной стороны колонии бесцветны или желтовато-коричневого цвета. Межвидовая дифференциальная диагностика основана на различиях в строении стеригм и конидий.
В препаратах из культуры можно обнаружить гладкие, короткие, зеленого цвета конидиеносцы. Воздушные гифы бывают септированы и без перегородок. Колбообразные вздутия, содержащие споры, находятся только в верхней части гифов. У стеригм одноярусное строение. Конидии темно-зеленого цвета, округлые, шиповатые или полушаровидной формы.
A.flavus, A. niger на агаре Чапека формируют широко разрастающиеся колонии с обильным спороношением. Цвет колонии зависит от массы конидий, развивающихся на конидиеносцах. При микроскопии культур обнаруживают бесцветный или светлоокрашенный септированный мицелий. Часто образуются склероции шаровидной формы, представленные толстостенными клетками.
Биопроба. Метод применяют для подтверждения патогенности выделенных культур аспергилл. Кроликам, морским свинкам или белым мышам вводят внутривенно суспензию спор грибов (0,5... 1) • 106, что вызывает развитие генерализованного процесса с типичным поражением органов дыхания, почек, сердца. При вскрытии в этих органах обнаруживают множество мелких узелков с интенсивным развитием гриба.
Птице скармливают корм, зараженный спорами аспергилла, или проводят ингаляцию спор в дыхательный аппарат.
С помощью микологических исследований дифференцируют аспергиллез от микозов, Вызванных другими плесневыми грибами.
Пенициллиомикоз. Заболевание многих видов животных, возникающее на фоне снижения общей резистентности организма и характеризующееся поражением кожи, слизистых оболочек.
Основные возбудители пенициллиомикоза — грибы рода Penicillium: P. crustosum, P. glaucum, P. mycetomagenum.
Лабораторная диагностика пенициллиомикоза основана на результатах микологического исследования. Диагностика данного микоза затруднена в связи с тем, что грибы рода Penicillium часто выделяют из легких и других тканей при туберкулезе и других инфекциях. Важным признаком для подтверждения диагноза служит обнаружение в очаге поражения элементов гриба, фагоцитированных макрофагами.
Микологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим и патогенным свойствам.
Материал для исследования. В лабораторию направляют пораженные участки кожи, слизистых оболочек, пораженные органы и ткани от трупов.
Микроскопия препаратов из исходного материала. Препараты «раздавленная капля» исследуют под микроскопом в окрашенном (по методам Грама, Циля—Нильсена и др.) и неокрашенном виде.
Важным диагностическим признаком служит обнаружение в нативных препаратах септированного мицелия и конидиеносцев, ветвящихся на вершине один или несколько раз в виде кисточки.
Выделение и идентификация культуры возбудителя. Материал высевают на сусло-агар, агары Чапека, Сабуро и др. и культивируют так же, как и возбудителей аспергиллеза и мукоромикоза. У выделенных культур грибов изучают морфологию колоний и внутреннюю структуру (табл. 36).

Биопроба. Заражают кроликов, морских свинок, крыс, белых мышей подкожно. На месте введения культуры грибов-возбудителей развивается абсцесс и формируется грануляционная ткань. При внутрибрюшинном и внутривенном введении развивается генерализованный процесс.
Мукоромикозы (мукорозы). Хронические заболевания, вызываемые плесневыми грибами. Характеризуются развитием гранулематозного процесса, сходного с туберкулезом, в лимфатических узлах и в легких, реже в других органах и тканях (кожа, ногти, слизистые покровы, пищеварительный тракт, центральная нервная система, мозг). К возбудителю мукороза восприимчивы свиньи, лошади, крупный рогатый скот, овцы, пушные звери; из лабораторных животных — морские свинки, мыши; болеют обезьяны, тюлени. Мукорозы людей встречаются в виде спорадических случаев.
Основные возбудители мукоромикоза — грибы видов Мисог mucedo, М. racemosus, Rhisopus nigricans и др.
Лабораторная диагностика мукоромикоза основана на результатах микологического исследования.
Микологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим и патогенным свойствам.
Материал для исследования. Объектом исследования служат некротизированные ткани, гной, экссудат, гранулематозные ткани и др.
Микроскопия препаратов из исходного материала. В препаратах из исследуемого материала в положительных случаях обнаруживают несептированный мицелий. В круглых спорангиях на спорангиеносце видны эндоспоры (рис. 125). Для старого мицелия характерно присутствие хламидоспор.
Рис. 125. Четырехдневная культура Мисог racemosus на агаре Чапека:
1 — мицелий;
2— спорангия;
3— спорангиоспоры внутри спорангии и вне ее;
4— спорангиеносец

Выделение и идентификация культуры возбудителя. Гранулематозную ткань обжигают над пламенем горелки и стерильно вырезают из середины кусочки, которые раскладывают на поверхности среды Чапека (в чашках Петри) или других сред. Посевы инкубируют при 25...30ºС. Культуры грибов довольно крупные, активно развиваются на искусственных питательных средах. На третьи сутки приобретают вид войлочных клочковатых серовато-белых колоний (рис. 126), в последующем цвет может изменяться до коричневого или бурого.

Рис. 126. Войлочно-клочковатая серовато-белая колония двухдневной культуры М. racemosus на агаре Чапека
Биопроба. Метод применяют для изучения патогенности выделенных из исходного материала культур гриба. Кроликам, морским свинкам и белым мышам вводят внутривенно, внутримышечно или внутрибрюшинно смыв спор и мицелия чистых культур. Гриб развивается во всех внутренних органах и тканях. Кролики погибают через 15...20 дней после внутривенного заражения, мыши — через 5... 15 дней. Чаще поражаются почки, реже печень, сердце, селезенка (абсцессы, некроз эпителия канальцев, разрастание грануляционной ткани).
Кандидамикоз (кандидоз, молочница и др.). Заболевание животных и человека. Характеризуется поверхностным поражением кожи, слизистых оболочек ротовой полости, наружных мочеполовых органов. Возбудитель также вызывает висцеральный микоз с поражением дыхательных путей, желудочно-кишечного тракта, мочеполовой системы, молочной железы, мышечной, костной и сердечно-сосудистой систем, органов зрения. При генерализации кандидамикозного процесса могут поражаться многие органы одновременно (рис. 127). Следствием кандидамикоза у коров могут быть маститы, эндометриты и аборты.
 Рис. 127. Серовато-белые мелкие узелки на слизистой зоба цесаренка, павшего от кандидамикоза
Рис. 127. Серовато-белые мелкие узелки на слизистой зоба цесаренка, павшего от кандидамикоза
Основные возбудители кандидамикоза — С. albicans и С. tropicalis, реже С. krusei, род Candida, класс Deuteromycetes. Они широко распространены в природе. Наиболее часто их выделяют с поверхности различных фруктов, ягод, овощей. Candida albicans и др. входят в состав нормальной микрофлоры организма человека и животных. Любые нарушения функций иммунокомпетентных клеток или нормального микробного ценоза приводят к возникновению заболевания. С. albicans в основном поражает птиц, кур, гусей, уток, цесарок, индеек, голубей, фазанов и др. Более тяжело болеют поросята, телята, ягнята, щенки.
Лабораторная диагностика кандидамикоза основана на результатах микологического исследования.
Микологическое исследование включает в себя обнаружение возбудителя в исходном материале методом световой микроскопии, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культу-рально-морфологическим и ферментативным свойствам.
Материал для исследования. Объектом исследования служат пленки, наложения, соскобы со слизистой оболочки, содержимое язв и эрозий, кусочки внутренних органов.
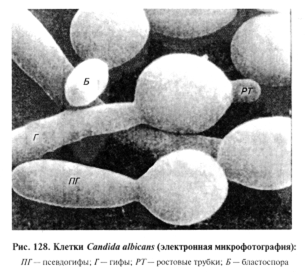
Микроскопия препаратов из исходного материала. В тканях животных С. albicans может образовывать дрожжевые клетки и гифы, обнаружение которых имеет диагностическое значение (рис. 128). Клеточная стенка мицелия в этом случае состоит из трех слоев и значительно уступает по толщине пяти-семислойной структуре дрожжевых клеток.
Выделение и идентификация культуры возбудителя. Материал (кроме внутренних органов) берут стерильной бактериологической петлей и тщательно растирают петлей или стеклянным шпателем по поверхности среды. Кусочки печени, селезенки или почек погружают в спирт, обжигают над пламенем спиртовки, а затем из глубины органов вырезают кусочек ткани и проводят им по поверхности плотной среды. Кровь из сердца, содержимое желудка и кишечника, почечной лоханки высевают на агар Сабуро в чашки Петри. Посевы инкубируют при 37° С 24...48 ч до появления на питательной среде колоний (рис. 129, 130).
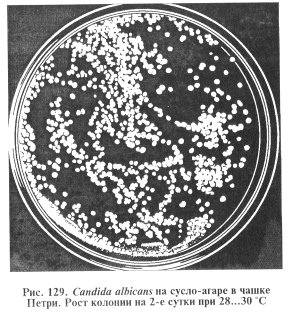

Идентификацию культур грибов проводят в два этапа.
На первом этапе изучают культурально-морфологические признаки выделенной культуры в первичном посеве на плотной питательной среде (агар Сабуро, МПА с глюкозой) (табл. 37).

На втором этапе для окончательной идентификации грибов рода Candida выделенную культуру высевают на жидкие питательные среды (бульон Сабуро, картофельный, кукурузный агары или на аналогичные жидкие среды — кукурузный или картофельный отвар) и определяют культуральные признаки и цитоморфологические особенности. Посев на картофельный и кукурузный агары делают штрихом в толщу среды, разрезая петлей поверхность агара. При микроскопии учитывают наличие псевдомицелия, тип роста на этих средах; присутствие хламидоспор на кукурузном агаре в чашках Петри исследуют при малом увеличении (рис. 131).

Рис. 131. Пятидневная культура С. albicans на кукурузном агаре:
1 — шаровидные хламидоспоры; 2— контурная оболочка хламидоспоры
На жидких питательных средах грибы С. albicans через 24...48 ч вызывают помутнение среды и образование рыхлого осадка на дне пробирки. Для грибов С. tropicalis и С. krusei характерны глубинный рост и образование пленки и пристеночного кольца.
Для дифференциации видов грибов рода Candida определяют ферментативную активность на жидких средах Гисса, содержащих 3 % различных углеводов и индикатор Андреде. Посевы наблюдают в течение 10... 15 дней, учитывают кислото- и газообразование. Ферментативные свойства приведены в таблице 38.

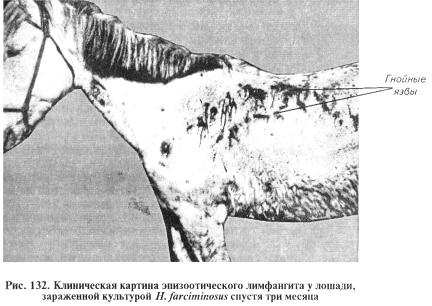
Эпизоотический лимфангит (бластомикоз, африканский сап). Хроническое заболевание животных. Характеризуется поражением лимфатических узлов, лимфатических сосудов и подкожной клетчатки с образованием язв, абсцессов и узелков. В отличие от дерматомикозов поражены более глубокие слои кожи. Болеют однокопытные животные: лошади, мулы, ослы, зарегистрированы случаи заболевания этим микозом парнокопытных — верблюдов и КРС (рис. 132).
Возбудитель эпизоотического лимфангита — Histoplasma farciminosus (син. Criptococcus farciminosus). Классификация криптококка неясна: одни исследователи причисляют его к бластомицетам, другие на основании некоторых биологических данных — к несовершенным грибам.
Лабораторная диагностика эпизоотического лимфангита основана на результатах микологического и серологического исследований.
Микологическое исследование включает в себя обнаружение возбудителя при микроскопии препаратов-отпечатков из исходного материала, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим и серологическим свойствам.
Материал для исследования. В лабораторию направляют содержимое абсцессов, гнойный экссудат язв.
Микроскопия препаратов из исходного материала. Готовят препарат «раздавленная капля». Чаще микроскопируют неокрашенный препарат или красят по Граму или Романовскому—Гимзе. Благодаря окраске гранулы в цитоплазме хорошо различимы. Возбудителя эпизоотического лимфангита относят к дрожжеподобным грибам. В исследуемом материале обнаруживают криптококки — клетки яйцевидной или ли монообразной формы с четко выраженной двухконтурной оболочкой, клетки заострены на одном или обоих концах. Размеры криптококков З...5мкм в длину и 2...3,5 мкм в ширину. В гное находят по 2...3 криптококка, соединенных своими полюсами и иногда образующих цепочки (рис. 133). Часть криптококков можно найти в лейкоцитах (нейтрофилах и макрофагах). Центральная часть криптококков представляет собой гомогенное, полужидкое вещество, содержащее одно или несколько (2...4) блестящих зернышек, которые находятся в беспрерывном и оживленном движении.
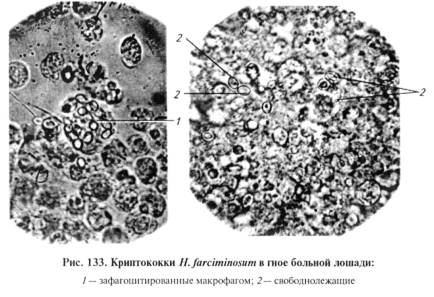
Необходимо учитывать, что для Н. farciminosus характерен диморфизм, т. е. морфология гриба в патологическом материале и в культуре различна.
Выделение и идентификация культуры возбудителя. В сомнительных случаях микроскопии материал высевают на питательные среды. Первичное выделение гриба затруднительно, но выделенную культуру удается поддерживать сравнительно легко. Гриб выращивают на МППА, глюкозно-глицериновом МПА (содержание углеводов 2...2,5 %), агаре Сабуро при температуре 25...30°С.
Через 10... 12 дней на плотных питательных средах образуются колонии, сначала мелкие, в последующем более крупные, возвышающиеся над поверхностью среды. Колонии складчатые, сухие, кремового, а позднее коричневого цвета. В мазках из культуры дрожжевые клетки не обнаруживают. Вне живого организма гриб развивается в мицелиальной форме. Мицелий септированный, ветвящийся, многоклеточный.
Серологическая диагностика основана на результатах РСК с сапным антигеном.
Аллергическая диагностика. Для аллергической диагностики лимфангита используют гистоплазмин (Королевой) — фильтрат 3...4-месячной культуры криптококка. При сомнительном результате лабораторного исследования применяют дифференциальную диагностику лимфангита и сапа, используя глазную пробу с маллеином и подкожную пробу с гистоплазмином.
Кокцидиоидомикоз (ревматизм пустыни, долинная лихорадка и др.). Хроническое заболевание животных и человека, характеризуется гранулематозным поражением лимфатических узлов, иногда легких у крупного рогатого скота и диссеминированной формой процесса со злокачественным течением у собак.
К заболеванию восприимчивы крупный рогатый скот, лошади, ослы, овцы, свиньи, грызуны (мыши, крысы и др.). Описаны заболевания койотов, лам, кенгуру, обезьян, тигров и других животных. Птицы не болеют. Кокцидиоидомикоз человека относят к группе особо опасных микозов.
Возбудитель кокцидиоидомикоза — дрожжевидный почвенный гриб Coccidioides immitis.
Лабораторная диагностика кокцидиоидомикоза основана на результатах микологического и серологического исследований.
Микологическое исследование включает в себя обнаружение возбудителя в исходном материале методами световой микроскопии и биопробы, выделение чистой культуры посевом на питательные среды и идентификацию возбудителя по культурально-морфологическим и патогенным свойствам.
Материал для исследования. Объектом исследования служат гной, кровь, содержимое очагов поражения и кусочки пораженных органов.
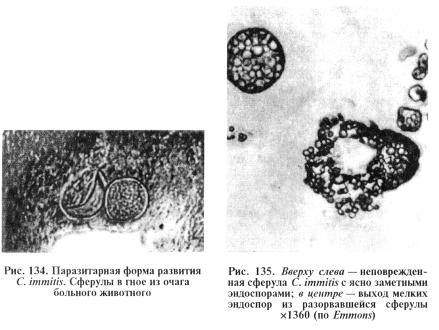
Микроскопия препаратов из исходного материала. Из материала готовят препараты «раздавленная капля». При работе с такими препаратами нужно соблюдать предельную осторожность, так как грибы остаются живыми. Можно микроскопировать препараты в 10%-м растворе щелочи при подогревании: в этом случае гриб погибает быстро, но происходит деформация сферул. Чтобы избежать заражения исследователя грибом С. immitis, перед микроскопией патологический материал рекомендуют залить 10%-м раствором формалина на 10...15 мин. Такая обработка убивает гриб, но не влияет на его морфологические признаки. Положительным результатом считают обнаружение сферул (например, в гное и мокроте) мицелия (рис. 134, 135). Сферулы — образования правильной круглой формы с двухконтурной оболочкой и с многочисленными эндоспорами. Протоплазма зернистая. Диаметр сферулы от 20 до 120 мкм. Эндоспоры мелкие. Иногда обнаруживают сферулы с разорванной оболочкой и освобождающимися эндоспорами. Прорастание сферул в мицелий можно наблюдать непосредственно в патологическом материале. Для этого на предметное стекло наносят несколько капель в смеси с физиологическим раствором, покрывают покровным стеклом и для предохранения от высыхания заклеивают парафином по краям. Отсутствие сферул в препаратах при микроскопическом исследовании не дает оснований отрицать кокцидиоидомикоз.
Выделение и идентификация культуры возбудителя. Для посева исследуемый материал предварительно обрабатывают антибиотиками в течение 30...60 мин для подавления бактериального роста. Пенициллин добавляют из расчета 20 ЕД/мл среды, стрептомицин — 40 ЕД/мл. Для получения мицелиальной формы гриба в качестве питательной среды используют агар Литмана, агар Сабуро, сусло-агар; для получения дрожжевидной формы — кровяной агар, печеночный агар с глюкозой, мартеновский бульон (табл. 39). Культивируют при 25...27 и 35...37 °С.

Биопроба. Заражают нативным материалом и солевой суспензией из чистой культуры гриба. К кокцидиоидомикозу восприимчивы мыши, морские свинки, кролики, собаки, куриные эмбрионы. При развитии патологического процесса в зависимости от метода введения исследуемого материала отмечают различные поражения.
При внутривенном введении культуры гриба развиваются абсцессы во внутренних органах, гибель животных наступает через 20...30 дней.
При интратрахеальном заражении обнаруживают поражение легких и трахеобронхиальных лимфатических узлов.
При внутрибрюшинном заражении через 7... 10 дней процесс распространяется по брюшине с поражением внутренних органов.
При подкожном и интрацеребральном методах заражения возникает местный процесс с поражением лимфатических узлов.
При интратестикулярном — развивается гнойный орхит. В гное обнаруживают сферулы различных размеров и на разных этапах созревания, реже мицелий.
Двух-трехдневные куриные эмбрионы погибают через 3...6 дней после заражения. Использованные в работе материалы и инструменты подлежат немедленной стерилизации в автоклаве.
Серологическая диагностика основана на результатах следующих реакций: РА с антигеном из убитой культуры, РСК с кокцидиоидином, РП с полисахаридным антигеном.
При работе с С. immitis необходимо соблюдать правила техники безопасности, в частности надевать марлевые маски. Посевы проводить лучше в пробирки со средой Литмана, мясо-пептонный бульон или другие жидкие среды, так как их удобнее использовать для микроскопических работ и заражения животных. На этих средах гриб образует более компактные, непылящие колонии. Пересев с твердых сред рекомендуют делать до начала спороношения.
ЗАДАНИЯ ДЛЯ САМОСТОЯТЕЛЬНОЙ РАБОТЫ
1. Приготовить и промикроскопировать препараты из материала от животных, больных дерматомикозом.
2. Изучить культуральные свойства возбудителей трихофитии и микроспории.
3. Изучить культурально-морфологические характеристики грибов родов Mucor, Aspergillus, Candida.
4. Ознакомиться с биопрепаратами.
Контрольные вопросы
1. Какие микроорганизмы вызывают дерматомикозы?
2. Какова схема лабораторного исследования на дерматомикозы?
3. По каким критериям дифференцируют грибы родов Microsporum и
Trichophyton?
4. Какие плесневые и дрожжеподобные грибы вызывают микозы?
5. Какие вакцины применяют против дерматомикозов сельскохозяйственных
животных?
Тема 38
ЛАБОРАТОРНАЯ ДИАГНОСТИКА МИКОТОКСИКОЗОВ, ВЫЗЫВАЕМЫХ ГРИБАМИ РОДОВ ASPERGILLUS, PENICILLIUM, FUSARIUM, STACHYBOTRYS, DENDRODOCHIUM
Цель занятий. Ознакомить студентов с характеристикой мико-токсинов, вызывающих микотоксикозы, грибами-продуцентами этих токсинов и методами исследований для постановки диагноза на микотоксикозы.
Оборудование и материалы. Культуры грибов родов Aspergillus, PeniciUium, Fusarium, Stachybothrys и др. на агаре Чапека или других средах в чашках Петри (в больших пробирках), препаровальные иглы или микологические крючки, предметные и покровные стекла, микроскопы, таблицы и плакаты по данной теме.
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Микотоксикозы. Болезни животных и человека; характеризуются отравлением, которое возникает при поедании кормов (пищи), содержащих токсические продукты жизнедеятельности микроскопических грибов-плесеней — микотоксины (от греч. mykes — гриб и toxinum — яд). Известно около 250 видов различных микроскопических грибов, продуцирующих 100 токсических метаболитов. Природными субстратами грибов-продуцентов микотоксинов служат разнообразные сельскохозяйственные культуры. К микотоксинам чувствительны почти все виды домашних, диких животных, птицы и рыбы. Наименование микотоксикоза происходит от названия токсина или гриба-продуцента. При диагностике микотоксикоза наибольшее внимание уделяют обнаружению токсина, поскольку гриб-продуцент в ряде случаев к моменту исследования погибает и, кроме того, один и тот же микотоксин могут синтезировать различные виды грибов.
Лабораторная диагностика микотоксикозов основана на результатах токсико-биологических, органолептических, микологических и физико-химических исследований.
Материал для исследования. В лабораторию направляют пробы всех кормов, входивших в суточный рацион животного в течение одного месяца до проявления болезни, а также остатки кормов из кормушек, содержимое желудочно-кишечного тракта павших животных и др. Отбор средних проб корма проводят ветеринарные и зооинженерные специалисты с представителями предприятий. Отобранную среднюю пробу делят на две части, упаковывают в чистые сухие стеклянные банки объемом 2...3 л, герметически закрывают и пломбируют. Одну часть отправляют в лабораторию, другую хранят в хозяйстве в течение одного месяца в условиях, предотвращающих порчу или вторичное загрязнение. В документе указывают цель исследования, вид кормового средства, назначение, массу всей партии, место отбора пробы, основные клинические признаки у больных животных. Прилагают копию акта вскрытия трупов (при гибели животных), копию экспертиз ветеринарной лаборатории об исключении инфекционных болезней и отравлений животных химическими или растительными ядами (если такие исследования были проделаны лабораторией).
Органолептическое исследование. Определяют внешний вид, цвет, запах корма, выявляют признаки, отличающие дефектный корм от доброкачественного (изменение цвета; затхлый, плесневелый или гнилостный запах; наличие на поверхности корма мицелия гриба и др.). О санитарном качестве зерна можно косвенно судить по цвету и состоянию зерновых оболочек.
Токсикологическое исследование. Проводят на различных биологических моделях: кроликах, аквариумных рыбках гуппи породы Винер, белых мышах или сельскохозяйственных животных.
На кроликах ставят кожную пробу. К 50 г измельченного корма добавляют 150 мл диэтилового эфира (эфир для наркоза) или ацетона. Смесь встряхивают при комнатной температуре с помощью шуттель-аппарата 3 ч. Экстракт фильтруют и выпаривают до полного исчезновения запаха. Налет, оставшийся на стенках чашки, смывают небольшим количеством эфира и используют для биопробы, которую ставят на кроликах массой 2...2,5 кг. Предварительно у кролика в области бедра, лопатки или бока выстригают участок кожи 6 см2. Пигментированная или с признаками шелушения кожа непригодна для исследования.
На одном кролике можно ставить не более четырех проб. На выстриженный участок кожи кролика наносят стеклянной лопаткой половину экстракта и легко втирают его. При восковидной консистенции экстракта его предварительно подогревают. Часть участка ос
Дата добавления: 2016-07-22; просмотров: 3925;











