Пиррол и его производные
Доступным синтетическим способом получения пиррола является метод Пааля-Кнорра, который заключается в конденсации 1,4-дикетона с аммиаком (или первичным амином):

Другим препаративным методом синтеза пиррола является перевод янтарной кислоты в циклическое производное – имид, который далее трансформируется в пиррол:
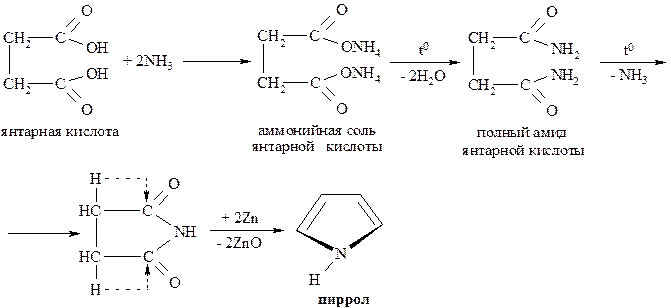
Пиррол представляет собой бесцветную жидкость с запахом, напоминающим хлороформ. Температура кипения 1300С.
При гидрировании пиррола можно получить пирролин (дигидропиррол) и пирролидин (тетрагидропиррол):

 Пиррол, его изомер – пирроленин, а также пирролин входят в состав макроциклической сопряженной системы – порфина, который ароматичен и содержит 26 обобщённых электронов. Порфин соответствует требованиям правила Хюккеля (4n + 2)π: здесь n=6. Рентгеноструктурные исследования свидетельствуют о плоской структуре порфина, энергия делокализации которого необычайно высокая и составляет 1045 кДж/моль:
Пиррол, его изомер – пирроленин, а также пирролин входят в состав макроциклической сопряженной системы – порфина, который ароматичен и содержит 26 обобщённых электронов. Порфин соответствует требованиям правила Хюккеля (4n + 2)π: здесь n=6. Рентгеноструктурные исследования свидетельствуют о плоской структуре порфина, энергия делокализации которого необычайно высокая и составляет 1045 кДж/моль:
Порфирины составляют структурную основу таких важных природных соединений, как гемоглобин и хлорофилл.
Гемоглобин, осуществляющий транспорт кислорода, представляет собой хромопротеид, состоящий из белковой части – глобина и небелкового компонента гема. Гем является порфирином, содержащим Fe(II). В зелёном пигменте растений – хлорофилле вместо железа содержится магний.
 Ядро пирролидина входит в состав аминокислоты пролина, представляющего собой α-пирролидинкарбоновую кислоту. Некоторые белки характеризуются высоким содержанием данной кислоты. В этом отношении следует отметить коллаген, который относится к фибриллярным белкам соединительной и костной тканей, сухожилий и хрящей.
Ядро пирролидина входит в состав аминокислоты пролина, представляющего собой α-пирролидинкарбоновую кислоту. Некоторые белки характеризуются высоким содержанием данной кислоты. В этом отношении следует отметить коллаген, который относится к фибриллярным белкам соединительной и костной тканей, сухожилий и хрящей.
 Ядро пиррола входит в состав конденсированной системы, состоящей из сочленённых ядер бензола и пиррола. Такая гетероциклическая система называется бензпирролом или индолом, в котором содержится 10π-электронов. В соответствии с правилом Хюккеля данная система является ароматической:(4n + 2)π, где n=2.
Ядро пиррола входит в состав конденсированной системы, состоящей из сочленённых ядер бензола и пиррола. Такая гетероциклическая система называется бензпирролом или индолом, в котором содержится 10π-электронов. В соответствии с правилом Хюккеля данная система является ароматической:(4n + 2)π, где n=2.
Нумерацию атомов в индоле производят от гетероатома против часовой стрелки, а атомы углерода в пиррольном фрагменте обозначают также буквами α- и β- (положения 2 и 3 соответственно).
Для препаративного получения индола используют метод Фишера, заключающийся в циклизации фенилгидразонов в присутствии H2SO4, H3PO4, BF3, ZnCl2 и др.
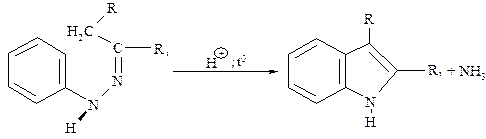
В индоле максимальная электронная плотность сосредоточена в положении 3, по которой в первую очередь происходит электрофильное замещение:
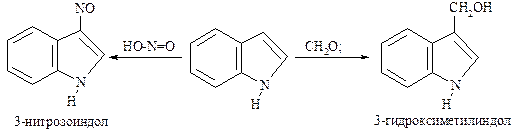
Производные индола по своей физиологической активности занимают исключительно важное положение. Среди этих соединений особо следует отметить триптофан, триптамин, серотонин, гетероауксин.
Триптофан или β-(3-индолил)-аланин – незаменимая аминокислота. При декарбоксилировании триптофана образуется один из важнейших биогенных аминов - триптамин. Под действием фермента моноаминооксидазы он превращается в β-индолилуксусную кислоту – гетероауксин,который является стимулятором роста растений.
При окислительном дезаминировании триптофана образуется 3-индолилпировиноградная кислота:
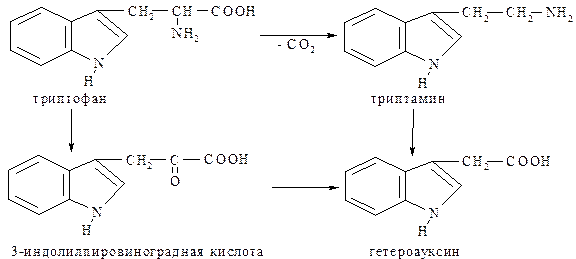
 Серотонин, 5-гидрокситриптамин. Гормоноподобное вещество; в значительных количествах содержится в тромбоцитах. Является медиатором (передатчиком) возбуждения в центральной нервной системе, влияет на тонус сосудов, увеличивает количество тромбоцитов в крови.
Серотонин, 5-гидрокситриптамин. Гормоноподобное вещество; в значительных количествах содержится в тромбоцитах. Является медиатором (передатчиком) возбуждения в центральной нервной системе, влияет на тонус сосудов, увеличивает количество тромбоцитов в крови.
Индиго (индиготин). Природный краситель, известный с глубокой древности. Относится к кубовым красителям: для перевода в растворимую форму его восстанавливают и полученным раствором обрабатывают ткань, на поверхности которой под действием кислорода воздуха происходит окисление и фиксация красителя на ткани:
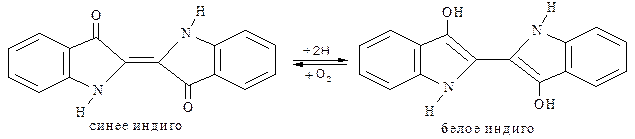
Дата добавления: 2020-10-01; просмотров: 1241;











