Химические свойства
Сходство электронного строения определяет много общего в химических свойствах.
- Каталитическое гидрирование осуществляется при высоких температурах и давлении в присутствии катализаторов (Ni; Pt; Pd), что приводит к соответствующим тетрагидропроизводным.
Пиррол и фуран гидрируются при умеренно мягких условиях и выход тетрагидропиррола (пирролидина) составляет почти 100%, а тетрагидрофурана – примерно 90%.
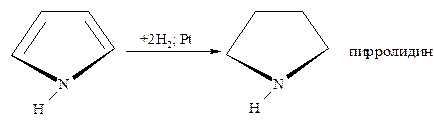
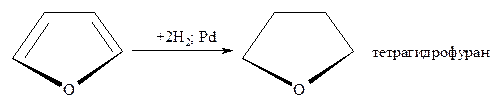
Труднее гидрируется тиофен и его производные, причём реакция может быть доведена до раскрытия цикла с образованием бутана и сероводорода:

- Взаимодействие с сильными кислотами. Ацидофобность.
В среде сильных кислородсодержащих неорганических кислот фуран, пиррол и тиофен ведут себя по-разному: пиррол и фуран, будучи слабыми основаниями, протонируются с последующим «осмолением» (олигомеризацией и полимеризацией).
Протонирование фурана и пиррола происходит преимущественно по α-положению и сопровождается разрушением стабилизированной замкнутой сопряжённой системы и последующими превращениями диена.

Таким образом, под влиянием сильных кислот пиррол и фуран претерпевают глубокие и, как правило, необратимые изменения. Такое свойство органических соединений принято называть ацидофобностью, что дословно означает «кислотобоязнь».
Наибольшей ацидофобностью характеризуются пиррол и фуран, Тиофен трудно протонируется, поэтому он наименее ацидофобен.
Введение электроноакцепторных заместителей - >С=О; –СООН; –NO2 и т.д. приводит к резкому снижению ацидофобности.
Реакции электрофильного замещения. В реакциях электрофильного замещения пиррол, фуран и тиофен проявляют большую реакционную способность, чем бензол. В этом случае фуран и пиррол близки к фенолу и ароматическим аминам. Тиофен менее реакционноспособен в SE-реакциях, чем пиррол и фуран, но значительно активнее бензола.
Реакции электрофильного замещения в фуране, пирроле и тиофене происходят преимущественно по положению С-2. Если же это положение занято, то замещение протекает по С-3.
Необходимо обратить внимание на тот факт, что ввиду ацидофобности нитрование и сульфирование фурана и пиррола следует проводить в гораздо более мягких условиях по сравнению с тиофеном и бензолом.
Для нитрования обычно используют ацетилнитрат, а для сульфирования – пиридинсульфотриоксид.
В отношении реакции галогенирования пиррол и фуран ведут себя по-разному: пиррол легко галогенируется без каких-либо особых условий с образованием, например, тетрабромпроизводного; фуран при хлорировании и бромировании образует монозамещённые продукты, которые легко полимеризуются.
Что касается тиофена, то SE реакции с его участием обычно проводятся в тех же условиях, что и бензола.
Ниже в виде схем приведены SE реакции для пиррола, фурана и тиофена.

По реакционной способности тиофен уступает фурану и пирролу. Например, для нитрования тиофена пригодны те же жёсткие условия, что и для бензола: эти реакции могут быть реализованы в условиях высокой кислотности. При хлорировании тиофена образуется сложная смесь, но бромирование и йодирование можно осуществлять направленно либо в положении 2, либо 2 и 4 одновременно.
Реакция ацилирования тиофена по Фриделю-Крафтсу проводится в присутствии хлорида алюминия.
При бромировании в качестве растворителя используется бензол, поскольку в SE реакциях тиофен значительно более реакционноспособен, чем бензол (примерно в 600-100000 раз), хотя большая часть реакций для этих соединений протекает по одинаковому механизму.
Обобщая приведённые выше реакции, следует отметить следующее:
- реакционная способность при электрофильном замещении ослабевает в последовательности: пиррол > фуран > тиофен > бензол;
- электрофильное замещение протекает преимущественно, а иногда исключительно по положению 2.
Несмотря на столь очевидную близость свойств рассматриваемых гетероциклов следует отметить, что в ряде случаев каждый из них проявляет присущую только ему особенность.
Так, в пирроле связь N–H достаточно полярная и поэтому гетероцикл характеризуется NH-кислотными свойствами (рКα≈16,5). По кислотности пиррол можно сравнить с этанолом. Замещение водорода NH осуществляется взаимодействием пиррола непосредственно с щелочным металлом (в жидком аммиаке) или концентрированной щёлочью:

Фуран и его производные во многих реакциях ведут себя как 1,3-диены, что используется в диеновом синтезе.
Очень важное значение имеют реакции, связанные с заменой гетероатома. Здесь особо следует отметить реакцию Ю.К. Юрьева, которая позволяет осуществлять каталитическое преобразование и взаимный переход друг в друга фурана, пиррола и тиофена:
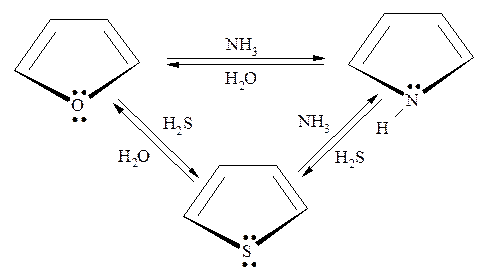
В реакции Ю.К. Юрьева используется оксид алюминия в качестве катализатора, а температурный режим процесса составляет 400-5000С.
Дата добавления: 2020-10-01; просмотров: 1073;











