Четвертичная структура белков.
Четвертичная структура белков варьирует в широких пределах, поэтому ее можно считать самой неопределенной.
Ряд белковых макромолекул могут соединяться друг с другом с образованием относительно крупных структур. Примером является гемоглобин, представляющий собой систему из четырех макромолекул. Именно такое сочетание компонентов гемоглобина обеспечивает присоединение и последующий транспорт кислорода в организме.
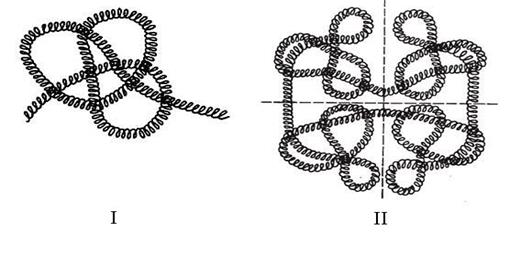
Полимерные образования, в которых мономерами являются макромолекулы белка, называются четвертичной структурой (рис.21.3).
Рисунок 21.2. Третичная(I) и четвертичная(II) структура белка
Физико-химические свойства белков.По агрегатному состоянию различают твердые, нерастворимые в воде и солевых растворах белки; жидкие или полужидкие (студнеобразные) белки, растворимые в воде или в растворах солей (глобулины).
В воде белки, как правило, образуют коллоидные растворы, которые опалесцируют, т.е. в проходящем свете кажутся прозрачными, а в отраженном мутными.
При действии электролитов или органических растворителей (спирт, хлороформ) на растворы белков происходит их осаждение (свертывание). Нагревание же приводит к необратимому осаждению и утрате многих свойств. Данное явление получило название денатурации белка, что подразумевает такое превращение белка, которое приводит к потере его естественных свойств. Следствием этого процесса является нарушение структуры белковой молекулы. Первичная структура каким-либо изменениям в этом случае не подвергается.
Для доказательства присутствия белка в биологических жидкостях и растворах, а также установления аминокислотного состава различных природных белков используют цветные реакции. Их применяют для качественного и количественного анализа белков, в том числе и содержащихся в них аминокислот.
Качественные реакции делят на две группы: универсальные и специфические.
К первой группе относятся, например:
а) биуретовая реакция (на все белки) — в щелочной среде раствор белка в присутствии солей меди (II) приобретает сине-фиолетовую окраску (см. разд. 17.4.3.);
б) нингидриновая проба (на все α-аминокислоты и белки) — при кипячении раствора белка с нингидрином появляется синее или сине-фиолетовое окрашивание (разд. 21.4. ).
Ко второй группе относятся:
а) ксантопротеиновая реакция (доказательство наличия остатков аминокислот, содержащих ароматическое ядро, например, фенилаланин) — раствор белка при обработке концентрированной азотной кислотой приобретает желтую окраску, переходящую в оранжевую при добавлении щелочи;
б) реакция Миллона (для белков, содержащих фрагмент фенола) — из раствора белка под действием реактива Миллона выделяется осадок кроваво-красного цвета.
Вопросы для самоподготовки
1. Дайте названия по заместительной номенклатуре четырёх структурных изомеров, имеющих состав С3Н7О2N. Для какого вещества возможна стереоизомерия?
2. Фталимид калия ввели в реакцию с этиловым эфиром 2-бром-3-метилбутановой кислоты и полученный продукт гидролизовали. Назовите образовавшееся соединение.
3. Восстановительным аминированием соответствующей кетокислоты получите лейцин. Какое строение эта аминокислота имеет в нейтральном, сильнощелочном, в сильнокислом растворах?
4. Из каких аминокислот и как могут быть получены 3,6-диметил-2,5-дикетопиперидин; бутеновая кислота; γ-бутиролактам; аланилглицин.
5. Дайте названия трипептидам, состоящим из двух молей глицина и одного моля фенилаланина. Укажите в них пептидные связи, С- и N-концевые группы.
6. Предложите методы синтеза анестезина и новокаина из бензола. С помощью каких реакций можно доказать, что вещества относятся к сложным эфирам; содержат ароматическое ядро и ароматическую аминогруппу.
Глава 22. Углеводы
Классификация
Дата добавления: 2020-10-01; просмотров: 554;











