Первичная структура белков
В белковой молекуле аминокислотные остатки многократно повторяются в строгой последовательности. Эта последовательность аминокислотных звеньев в линейной полипептидной цепи называется первичной структурой белка. Для определения последовательности аминокислотных остатков используют химические методы гидролиза, а также ферментативный гидролиз с помощью различных протеаз.
Важным этапом является определение молекулярной массы белка и установление молярного соотношения аминокислот после полного гидролиза.
Изменяя условия ферментативного и химического гидролиза (рН; температурный режим; время гидролиза), можно расщепить белковую молекулу на отдельные фрагменты, состоящие из меньшего числа аминокислотных остатков. Конечно, особое значение имеет определение концевых аминокислот. Если использовать фермент карбоксипептидазу, то можно идентифицировать
С-концевую аминокислоту (аминокислотный остаток со свободной карбоксигруппой), поскольку под действием этого фермента происходит селективное (избирательное) отщепление данной аминокислоты от полипептида или белка. Подобную операцию можно повторять многократно до полного определения аминокислотной последовательности в фрагменте, полученном гидролитическим расщеплением полипептида.
Существует и другой метод (метод Эдмана), предназначающийся для идентификации N-концевых аминокислот (аминокислотный остаток со свободной аминогруппой). Этот метод основан на реакции свободной аминогруппы концевого аминокислотного остатка с фенилизотиоцианатом. Полученный продукт подвергают гидролизу трифторуксусной кислотой, в результате чего отщепляется фенилгидантоин, а полипептидная цепь укорачивается на один аминокислотный остаток:
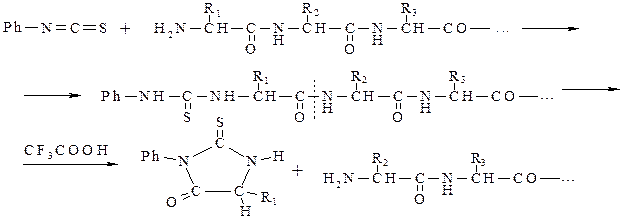
Далее идентифицируют аминокислоту в полученном гидантоине, после чего реакцию с фенилизотиоцианатом повторяют до полного определения всей последовательности аминокислот. С помощью метода Эдмана можно проанализировать полипептиды, состоящие из 50 аминокислотных остатков.
Анализ последовательности аминокислот не ограничивается приведенными выше методами. В настоящее время известно множество других приемов и методов, комбинированное применение которых позволяет расшифровать строение пептидов. Например, пептидные связи, образованные триптофаном, легко расщепляются бромсукцинимидом; пептидную связь с участием метионина расщепляет бромциан, а фермент трипсин гидролизует связи с участием аргинина и лизина.
Первым полипептидом, в котором была установлена аминокислотная последовательность, является бычий инсулин, состоящий из 51 аминокислоты.
Дата добавления: 2020-10-01; просмотров: 500;











