Пара – (Аминометил) – бензойная кислота – амбен, памба

По своему фармакологическому действию этот препарат является аналогом e-аминокапроновой кислоты, но более активен.
пара – Аминобензойная кислота (ПАБК). Является структурным фрагментом фолиевой кислоты, относящейся к витаминам группы «В»:
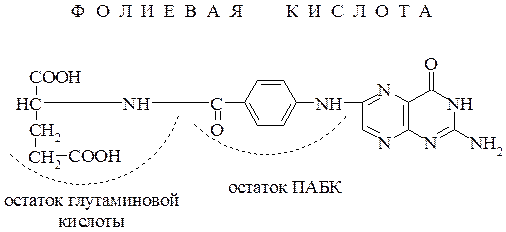
Сама фолиевая кислота играет важнейшую роль в образовании клеток крови, стимулирует эритропоэз, а также участвует в синтезе метионина, серина и других аминокислот, а также пуринов, пиримидинов и нуклеиновых кислот.
В медицине применяют для стимулирования эритропоэза при анемиях и лейкопениях.
Открытие фолиевой кислоты позволило окончательно выяснить механизм действия сульфаниламидных препаратов как антагонистов пара-аминобензойной кислоты (ПАБК). Известно, что ПАБК является фактором роста микроорганизмов: бактерии используют ее для биосинтеза 7,8-дигидрофолиевой кислоты. Эту реакцию катализирует фермент дигидрофолатсинтетаза, которую конкурентно ингибируют сульфаниламидные препараты благодаря своему большому сходству с ПАБК: наличие первичной ароматической аминогруппы, длина молекулы, значение рКa и т.д.
Следует отметить, что сульфаниламиды проявляют избирательную антимикробную активность только в отношении тех штаммов микроорганизмов, которые сами синтезируют фолиевую кислоту, используя ПАБК, поступающую извне.
Из производных пара-аминобензойной кислоты в медицине очень широко применяются сложные эфиры – анестезин (этиловый эфир) и новокаин (диэтиламиноэтиловый эфир) в качестве местных обезболивающих средств ненаркотического действия:
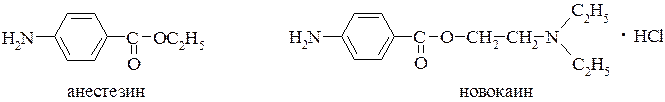
Белки
Выше было показано, что аминокислоты способны взаимодействовать между собой по принципу «голова к хвосту», т.е. карбоксильная группа первой аминокислоты взаимодействует с аминогруппой второй кислоты, а карбоксильная группа второй кислоты – с аминогруппой третьей кислоты и т.д. Это приводит к формированию пептидов с разным числом аминокислотных остатков – дипептидов, трипептидов, тетрапептидов и т.д. полипептидов:

Принято условно считать, что пептиды, имеющие относительную молекулярную массу до 10 000, следует называть полипептидами, а пептиды с большей молекулярной массой — белками (или протеинами; от греч. «proteios» — первый, самый главный). Такое название оправдано, поскольку белки являются основой всего живого. Они выполняют самые различные функции, входят в состав клеток и тканей всех живых организмов и наряду с углеводами и жирами являются главной составной частью нашей пищи.
В каждом живом организме число белков достигает нескольких тысяч, что на первый взгляд, может показаться невероятным. Ведь число аминокислот, из которых построены белковые молекулы, составляет всего 20! Какое число комбинаций возможно из этого количества аминокислот? Расчеты показывают, что из 20 аминокислот может быть составлено примерно 2×1018 последовательностей, причем ни одна из аминокислот не будет повторяться дважды. Если же учесть, что одна и та же аминокислота может участвовать в полипептиде многократно, то из 20 аминокислот, представленных в полипептидной цепи в равных соотношениях, число возможных последовательностей возрастает на сотни порядков. Каждый из разновидностей белков выполняет свою специфическую функцию: одни проявляют ферментативную активность, например, трипсин. Другие являются гормонами (инсулин). Третьи выполняют транспортную функцию (гемоглобин) и т.д.
Огромное разнообразие биохимических функций белков объясняется, прежде всего, тем, что каждый белок имеет свою, характерную для него последовательность аминокислотных звеньев.
Вместе с тем следует подчеркнуть, что белки как класс природных соединений по своей биологической и биохимической значимости являются прерогативой биохимии и биофизики.
В настоящем же разделе будут рассмотрены вопросы, в большей степени относящиеся к химическим особенностям белков.
Все природные белки, как правило, состоят из пяти химических элементов, содержание которых в различных белках близко и колеблется в незначительных пределах: 50-53% С; 7-8% Н; 20-24% О; 16-18% N; 0,5—1,8% S. Из других элементов встречается фосфор, реже — железо.
По химическому составу белки делят на две основные группы. К первой группе, называемой протеинами, относятся те белки, при гидролизе которых образуются только аминокислоты.
Вторую группу составляют белки, которые при гидролизе помимо аминокислот дают и другие компоненты. Их называют сложными белками (или протеидами). Неаминокислотная часть сложного белка именуется простетической группой, по которой и осуществляется классификация таких белков.
По форме молекул все белки делят на две большие группы: волокнистые (или фибриллярные) и глобулярные. Первые представляют собой нерастворимые в воде длинные нитевидные молекулы, полипептидные цепи которых не имеют глобулярной формы, а вытянуты вдоль одной оси. Большинство фибриллярных белков выполняет структурные или защитные функции.
В глобулярных белках полипептидные цепи свернуты в плотную компактную структуру сферической или глобулярной формы. К белкам данного типа относятся почти все ферменты, транспортные белки крови, антитела, а также пищевые белки.
Дата добавления: 2020-10-01; просмотров: 591;











