Основные фазы роста клеток в реакторах периодического действия
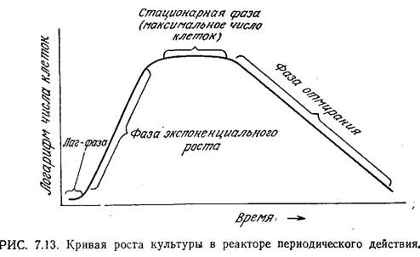 Как показано на рис. 7.13, в типичном периодическом процессе число живых клеток изменяется во времени. После лагфазы (фазы задержки, латентной фазы), в течение которой численность популяции практически не изменяется, наступает период быстрого роста, когда число клеток возрастает во времени экспоненциально. Часто эту стадию роста культур клеток в реакторе периодического действия называют логарифмической фазой (лаг-фазой); мы предпочитаем более точный термин - экспоненциальный рост, который и будем использовать в последующем изложении.
Как показано на рис. 7.13, в типичном периодическом процессе число живых клеток изменяется во времени. После лагфазы (фазы задержки, латентной фазы), в течение которой численность популяции практически не изменяется, наступает период быстрого роста, когда число клеток возрастает во времени экспоненциально. Часто эту стадию роста культур клеток в реакторе периодического действия называют логарифмической фазой (лаг-фазой); мы предпочитаем более точный термин - экспоненциальный рост, который и будем использовать в последующем изложении.
Понятно, что в закрытом сосуде клетки не могут размножаться бесконечно, и вслед за фазой экспоненциального роста наступает стационарная фаза. В этот момент число клеток достигает максимума. В конце концов стационарная фаза сменяется фазой отмирания, когда число клеток начинает снижаться. Здесь также часто наблюдается экспоненциальное снижение, численности популяции живых организмов.
В микробиологических процессах важную роль может играть любая из фаз. Так, при разработке процесса одной из его задач может быть сокращение до минимума продолжительности лаг-фазы и достижение максимальной длительности фазы экспоненциального роста (и скорости роста клеток в этой фазе); вторая цель в свою очередь достигается путем искусственного торможения перехода к стационарной фазе. Часто очень важно к концу процесса добиться максимальной плотности популяции клеток, что возможно только при условии учета всех переменных, влияющих на фазы роста культуры. В последующем изложении мы будем рассматривать каждую фазу отдельно и в соответствующие моменты обсудим математические модели наиболее важных явлений. Это обсуждение мы продолжим в разд. 7.3.2, где рассмотрим математические модели всего процесса клеточного роста в реакторе периодического действия.
Продолжительность лагфазы, наступающей после инокуляции свежей среды, зависит как от изменений в составе питательных веществ (если такие изменения имеют место), так и от возраста и массы инокулята. Сопровождающее перенос клеток из одной среды в другую резкое изменение условий может оказывать на живые клетки разностороннее действие. Во-первых, как мы уже знаем, системы контроля и регуляции ферментативной активности включают и адаптационные механизмы; в частности, сталкиваясь с новым питательным веществом, клетка начинает его усваивать только после синтеза новых ферментов. Поэтому, например, перенос находящейся в экспоненциальной фазе культуры из глюкозной среды в лактозную всегда сопровождается периодом с незначительной скоростью деления клеток; в этот период в клетках синтезируются ферменты и кофакторы, участвующие в пути метаболизма лактозы. (Что произойдет, если выращенную на лактозе культуру перенести в глюкозо-лактозную среду) Аналогично лаг-фаза может наступить и после изменения концентраций питательных веществ. Если новая питательная среда богаче лимитирующим клеточный рост питательным веществом, то в течение некоторого времени это вещество будет расходоваться не на рост клеток, а на повышение концентраций метаболизирующих ферментов. Снижение концентрации питательного вещества может и не сопровождаться лаг-фазой; в этом случае экспоненциальный рост возобновляется сразу же после снижения концентрации, но скорость клеточного роста снижается.
 Для активации многих внутриклеточных ферментов необходимы те или иные низкомолекулярные соединения (витамины, кофакторы) или ионы металлов (активаторы), которые могут проникать через клеточные мембраны. Перенос небольшого объема культуры клеток или инокулята в значительно больший объем среды вызовет обратную диффузию этих необходимых для ферментативного катализа веществ в среду, если в последней они отсутствуют или если среда резко отличается от инокулята по своей ионной силе. В таком случае опять-таки скорость роста упадет соответственно понижению концентрации активаторов в клетке, что в свою очередь, повлечет за собой лаг-фазу на период «включения» новых механизмов синтеза этих активаторов. Если в описанных процессах снижаются концентрации незаменимых активаторов (ионов и витаминов, которые не могут синтезироваться в клетке), то общий уровень клеточной активности должен снизиться необратимо.
Для активации многих внутриклеточных ферментов необходимы те или иные низкомолекулярные соединения (витамины, кофакторы) или ионы металлов (активаторы), которые могут проникать через клеточные мембраны. Перенос небольшого объема культуры клеток или инокулята в значительно больший объем среды вызовет обратную диффузию этих необходимых для ферментативного катализа веществ в среду, если в последней они отсутствуют или если среда резко отличается от инокулята по своей ионной силе. В таком случае опять-таки скорость роста упадет соответственно понижению концентрации активаторов в клетке, что в свою очередь, повлечет за собой лаг-фазу на период «включения» новых механизмов синтеза этих активаторов. Если в описанных процессах снижаются концентрации незаменимых активаторов (ионов и витаминов, которые не могут синтезироваться в клетке), то общий уровень клеточной активности должен снизиться необратимо.
На длительность лаг-фазы очень большое влияние оказывает фаза роста, в которой находится инокулят, полученный в свою очередь путем культивирования клеток в небольшом реакторе периодического действия. Объем инокулята также является важной переменной; в частности, как мы уже упоминали, она влияет на количество диффундирующих в среду веществ, например витаминов и активаторов. Так, перенос популяции молодых клеток в среду, богатую промежуточными метаболитами (например, аминокислотами), не сопровождается лаг-фазой; напротив, при переносе того же самого инокулята в среду с сульфатом аммония клетки будут обедняться жизненно важными промежуточными веществами за счет их транспорта в раствор. Если в момент переноса культура находится в фазе экспоненциального роста, то в среде инокулята уже должны содержаться в значительных концентрациях продукты промежуточного метаболизма, поэтому сопровождающее перенос разведение окажет меньший эффект.
Перенос в аммониево-сульфатную среду старой культуры (находящейся в стационарной фазе или близкой к ней) приведет к более длительной лаг-фазе. Если среда содержит несколько источников углерода, то иногда можно наблюдать ряд последовательных лаг-фаз (рис. 7.14). Это явление, называемое диауксией (двухфазным ростом), обусловливается изменением метаболического механизма в процессе роста. При диауксии клетки сначала усваивают один источник углерода, а затем, когда это питательное вещество истощается, клеткам приходится переключать свою активность с роста на «перестройку», необходимую для усвоения нового источника углерода. В основе такой последовательной утилизации питательных веществ, возможно, лежит явление катаболитной репрессии, рассмотренное в разд. 6.1.4.
Попытки свести к минимуму время роста культуры и всего процесса обычно включали сокращение продолжительности лаг-фазы, типичной для любого периодического процесса с участием микроорганизмов. Из уже рассмотренного нами материала и ряда других данных (описанных в приведенной в конце главы литературе) вытекают следующие общие принципы:
1. Культура инокулята должна обладать максимальной активностью, а в момент введения в среду инокулят должен находиться в фазе экспоненциального роста.
2. Среда, в которой выращивается инокулят, по своему составу должна быть близкой к составу среды крупномасштабного микробиологического процесса.
3. Для предотвращения обусловленных диффузией потерь незаменимых промежуточных веществ и активаторов целесообразно применять инокулят большего объема (до 5—10% от объема новой среды).
К концу лаг-фазы популяция микроорганизмов приспосабливается к новым условиям. Теперь клетки могут быстро размножаться, и клеточная масса (или число живых клеток) удваивается через определенные промежутки времени. Увеличение числа клеток в этот период может быть описано уравнением

Как и в случае роста клеток в стационарном состоянии в ПРПП, для описания популяции в ходе экспоненциального роста в периодическом процессе необходим только один параметр µ (или td). В первом приближении можно считать, что в этой фазе рост периодической культуры сбалансирован. Следовательно, путем изучения роста культуры клеток в реакторе периодического действия можно получить полезные данные о кинетике сбалансированного роста, если только это изучение ограничено фазой экспоненциального роста.
Экспоненциальный рост заканчивается, когда одна из важных переменных процесса (например, концентрация питательного вещества или токсина) достигает значения, не обеспечивающего максимальную скорость роста клеток. Истощение запасов лимитирующего рост питательного вещества может привести к очень резкому изменению скорости клеточного роста, поскольку в экспоненциальной фазе общая скорость утилизации питательного вещества возрастает очень быстро. Чтобы найти описывающее это явление приближенное математическое выражение, предположим, что до установления стационарной фазы скорость потребления питательного вещества А пропорциональна массовой концентрации живых клеток:
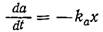
Допустим далее, что экспоненциальный рост продолжается до тех пор, пока не установится стационарная фаза, и что экспоненциальный рост начинается в нулевой момент времени. Тогда

где хо — массовая концентрация живых клеток в момент начала экспоненциального роста.
Если в нулевой момент времени концентрация А равна aо, то из уравнений (7.38) и (7.39) следует, что А будет полностью утилизировано, когда
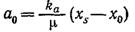
Здесь xs—массовая концентрация популяции в тот момент, когда вещество А истощено и популяция переходит в стационарную фазу.
Следовательно, xs представляет собой максимальную концентрацию биомассы в периодическом процессе (ср. рис. 7.13). Преобразованием уравнения (7.40) можно получить уравнение, выражающее максимальную концентрацию биомассы в момент истощения питательного вещества:
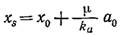
Линейная зависимость xs от начальной концентрации питательного вещества ао во многих случаях наблюдалась экспериментально (x0 часто настолько мало, что им можно пренебречь). Пример такого поведения популяции клеток приведен на рис. 7.15. В то же время график зависимости ns (численной плотности клеток в стационарной фазе) бактерии A. aerogenes от концентрации лактозы заметно отличается от зависимости, предсказываемой уравнением (7.41).
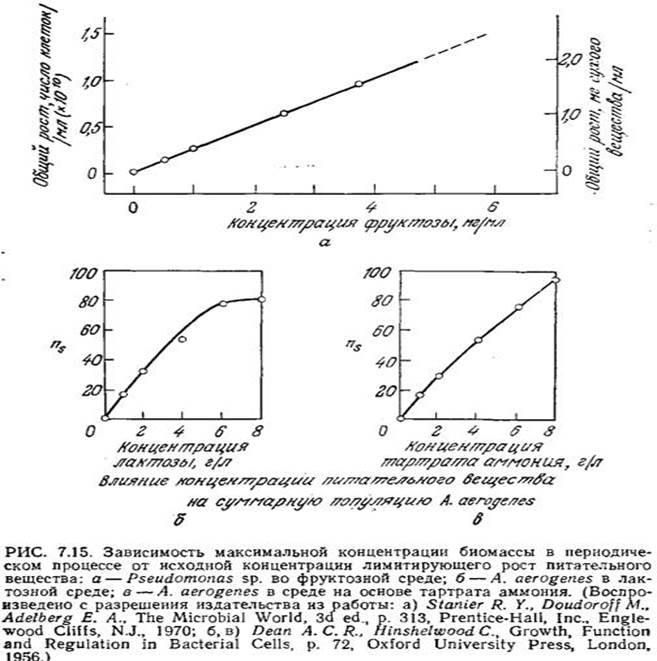
Очевидно, на начало стационарной фазы и максимальную концентрацию биомассы могут влиять и другие факторы.

Согласно уравнению (7.42), рост клеток прекращается только тогда, когда ct достигает значения, равного 1/b. Разведение данной среды, содержащей токсин, или введение непитательного вещества, связывающего этот токсин, должно сопровождаться возобновлением клеточного роста и, следовательно, увеличением максимальной концентрации биомассы xs в стационарной фазе. Если рост сдерживается истощением питательного вещества, то разведение раствором, не содержащим питательных веществ, не влияет на xs. Этими зависимостями можно пользоваться в качестве критериев для предварительной оценки причин снижения скорости и прекращения клеточного роста. Более точные критерии сформулировать труднее, поскольку, как мы увидим позднее, рост популяции клеток в условиях истощения основного питательного вещества замедляется несколько раньше, чем это вещество полностью утилизируется, а скорость роста клеток в присутствии токсина может стать неизмеримо малой задолго до того момента, когда dx/dt станет равным нулю.
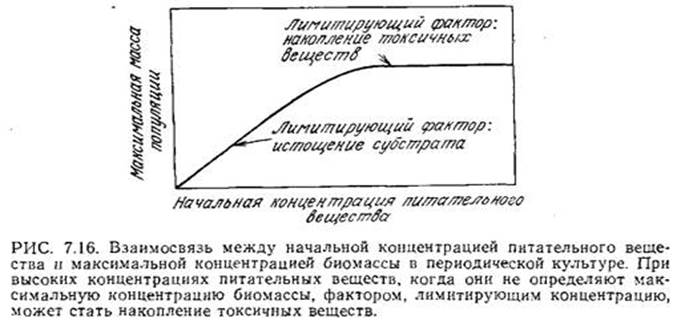 На рис. 7.16 изображена предсказываемая теорией зависимость максимальной концентрации биомассы от исходной концентрации данного питательного вещества.
На рис. 7.16 изображена предсказываемая теорией зависимость максимальной концентрации биомассы от исходной концентрации данного питательного вещества.
Постепенное снижение концентрации питательного вещества в конце концов приводит к линейной зависимости максимальной концентрации биомассы от начальной концентрации питательного вещества. В этом случае отсутствие фазы экспоненциального роста, очевидно, вызвано недостатком питательного вещества. Напротив, повышение начальной концентрации питательного вещества может привести к тому, что величина xs в конце концов перестанет быть зависимой от а0; возможно, это объясняется накоплением токсичных веществ или влиянием другого лимитирующего клеточный рост питательного вещества.
Изучая всю популяцию, мы не должны забывать о судьбе индивидуальных клеток. В общем случае популяции всегда негомогенны, и кривая роста популяции в периодическом процессе отражает лишь некоторый усредненный параметр чрезвычайно сложной системы. Во время фазы экспоненциального роста, например, некоторые клетки делятся и порождают новые, молодые клетки, а другие в тот же самый момент растут и созревают. Поскольку клетки разного возраста обычно имеют различные размеры и химический состав, мы можем рассматривать клетки одного возраста как некоторое «вещество». С этой точки зрения рост одного вида микроорганизма приводит к популяции, содержащей множество различных «веществ».
Гетерогенность популяции становится особенно заметной в стационарной фазе и фазе отмирания. Так, в стационарной фазе некоторые клетки делятся, а некоторые погибают. Мертвые клетки часто подвергаются лизису (разрушению и растворению); в результате углеводы, аминокислоты и другие компоненты клеток попадают в среду и становятся питательными веществами для живых членов популяции. Такой каннибализм способствует сохранению массы популяции в стационарной фазе. В конце концов, однако, истощение питательных веществ и накопление токсинов приводит к тому, что популяция не может поддерживать далее свое существование и наступает фаза отмирания.
Фазе отмирания было посвящено сравнительно небольшое число исследований, возможно, вследствие того, что многие промышленные микробиологические периодические процессы заканчиваются задолго до наступления этой фазы. Обычно считается, что гибель популяции подчиняется экспоненциальному закону: х=хse-kt (7.48)
В этом уравнении t означает время, прошедшее с начала фазы отмирания
В основу уравнения (7.48) положено допущение о том, что в любое время погибает одна и та же доля живых клеток.
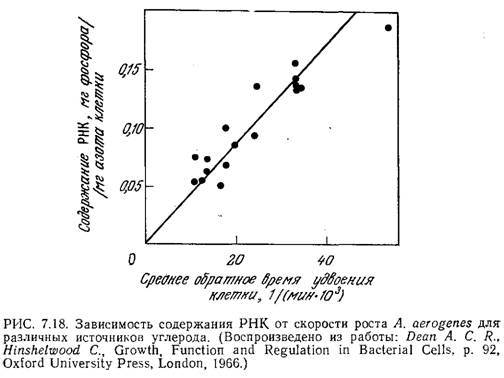 Одно из объяснений экспоненциального уменьшения численности популяции в фазе отмирания заключается в том, что в культуре клеток летальный исход является случайным событием и гибель данной клетки определяется только вероятностью этого события. Недостатком такого объяснения является пренебрежение историей популяции. Дин и Хиншелвуд предположили, что в стабильной и отмирающей популяциях не только живые клетки существуют за счет отмерших, но и конкурирующие участки метаболического механизма клетки в борьбе за дефицитные промежуточные соединения также существуют один за счет другого [3]. Если принять это предположение, можно показать, что скорость гибели клеток должна подчиняться экспоненциальному закону. Другие модели снижения численности популяции мы обсудим в разд. 7.7.
Одно из объяснений экспоненциального уменьшения численности популяции в фазе отмирания заключается в том, что в культуре клеток летальный исход является случайным событием и гибель данной клетки определяется только вероятностью этого события. Недостатком такого объяснения является пренебрежение историей популяции. Дин и Хиншелвуд предположили, что в стабильной и отмирающей популяциях не только живые клетки существуют за счет отмерших, но и конкурирующие участки метаболического механизма клетки в борьбе за дефицитные промежуточные соединения также существуют один за счет другого [3]. Если принять это предположение, можно показать, что скорость гибели клеток должна подчиняться экспоненциальному закону. Другие модели снижения численности популяции мы обсудим в разд. 7.7.
Дата добавления: 2020-10-01; просмотров: 1021;











