Катализаторы каталитического крекинга
Катализаторы крупнотоннажных процессов каталитического крекинга, осуществляемых при высоких температурах в режиме интенсивного массо- и теплообмена в аппаратах с движущимся или псевдоожиженным слоем катализатора, должны обладать не только высокими активностью, селективностью и термостабильностью, но и удовлетворять повышенным требованиям к ним по регенерационным, механическим и другим эксплуатационным свойствам [2]. Промышленные катализаторы крекинга представляют собой сложные многокомпонентные системы, состоящие из: 1) матрицы-носителя; 2) активного компонента – цеолита; 3) вспомогательных добавок.
Матрица выполняет функции как носителя – поверхности, на которой диспергируют основной активный компонент – цеолит и вспомогательные добавки, так и слабого кислотного катализатора предварительного первичного крекирования высокомолекулярного исходного сырья. В качестве материала матрицы применяют синтетический аморфный алюмосиликат с высокой удельной поверхностью и оптимальной структурой пор, обеспечивающей доступ для крупных молекул сырья.
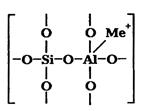
Алюмосиликатные катализаторы представляют собой гранулированные вещества, обладающие высокой удельной поверхностью (400-1000 м2/г). По своей химической природе алюмосиликатные катализаторы являются слабыми кислотами. Кристаллическая решетка аморфных алюмосиликатов может рассматриваться как трехмерная кристаллическая решетка поликремневой кислоты, в которой часть атомов кремния заменена на атомы алюминия (рис. 3.3) [11]:
Химический состав алюмосиликатного катализатора рассматривают как смесь оксида алюминия и оксида кремния, находящихся в химическом соединении, химическая формула алюмосиликатного катализатора представлена следующим образом:
n Al2O3 · m SiO2 · у H2O
где n – число молей оксида алюминия;
m – число молей оксида кремния;
у – число молей воды.
Оксид алюминия и оксид кремния в отдельности или в виде механической смеси не являются катализаторами крекинга.
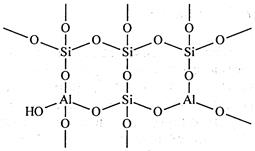
Рис. 3.3. Схема аморфного алюмосиликатного катализатора
В настоящее время в нефтеперерабатывающей промышленности широко применяются кристаллические алюмосиликатные цеолитсодержащие катализаторы крекинга, содержащие до 20 % мас. цеолитов на аморфной алюмосиликатной матрице.
Цеолитсодержащие катализаторы крекинга активнее аморфных алюмосиликатных катализаторов (выход бензина выше на 30-50 %). Бензин, полученный при крекинге на аморфном алюмосиликатном катализаторе, содержит 30 % ароматических углеводородов, 42 % нафтенов, 12 % олефинов, 12 % алканов. Бензин, полученный из того же сырья на цеолитсодержащем катализаторе, содержит 50 % ароматических углеводородов, 22 % нафтенов, 5 % олефинов и 25 % алканов.
Цеолиты в чистом виде не могут быть применены в качестве катализаторов крекинга из-за малых размеров пор, так как при крекинге не используется полностью внутренняя поверхность гранул цеолита (крекинг протекает в диффузионной области). Средний размер диаметра пор аморфного алюмосиликатного катализатора равен 30-50 Å, размер диаметра пор цеолитов – 3-10 Å, средний диаметр молекул полициклических углеводородов в сырье каталитического крекинга достигает 13-15 Å и более. Поэтому применяют алюмосиликатные цеолитсодержащие катализаторы.
Цеолиты представляют собой алюмосиликаты с трехмерной кристаллической структурой с общей формулой [2]:
Ме2/nО · Al2O3 · х SiO2 · у H2O,
где n – валентность катиона металла Ме;
х – мольное соотношение оксидов кремния и алюминия,
называемое силикатным модулем;
у – число молей воды.
Насчитывается несколько десятков разновидностей природных и синтетических цеолитов, отличающихся структурой, типом катионов Ме, силикатным модулем и числом молекул кристаллизационной воды. Структура цеолитов характеризуется наличием большого числа полостей, соединенных между собой окнами, или микроканалами, размеры которых сравнимы с размерами реагирующих молекул. Полости имеют больший диаметр, чем каналы или окна.
Цеолиты подразделяются в зависимости от величины силикатного модуля х на следующие структурные типы [7]:
Тип цеолита х
Цеолит А . . . . . . . . . . . . . . . . 1,8-2,0
Цеолит Х . . . . . . . . . . . . . . . . 2,3-3,0
Цеолит Y . . . . . . . . . . . . . . . . 3,0-6,0
Эрионит (цеолит Т) . . . . . . . . . 6,0-7,0
Морденит . . . . . . . . . . . . . . . 8,3-10,7
Цеолит L . . . . . . . . . . . . . . . . 10,0-35,0
При обозначении типа структуры синтетического цеолита перед буквами ставят химическую формулу катиона металла, компенсирующего отрицательный заряд алюминия в алюмосиликате. Например, CaX означает цеолит типа Х в кальциевой обменной форме; LaY, ReY – соответственно лантановая и редкоземельная форма цеолита Y.
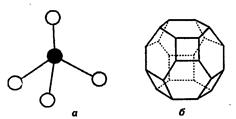
Первичной основной (структурной единицей) кристаллической решетки цеолитов X и Y является тетраэдр, состоящий из четырех анионов кислорода, которые окружены значительно меньшими по размерам ионами кремния или алюминия (рис. 3.4, а) [2, 7].
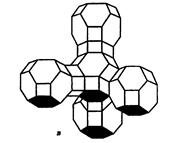
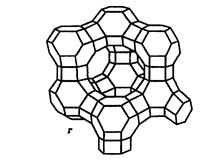
Двадцать четыре тетраэдра образуют вторичную структурную единицу – усеченный октаэдр (кубооктаэдр, который содержит восемь шестиугольных и шесть квадратных поверхностей), так называемую содалитовую клетку (рис. 3.4, б). На следующей ступени структурирования четыре кубооктаэдра объединяются в тетраэдрическую конфигурацию вокруг пятого при помощи шестиугольных призм, образуя суперклетку (рис. 3.4, в). В результате объединения множества суперклеток (в фожазите их 8) в регулярную систему формируется элементарная ячейка цеолита (рис. 3.4, г).
|
| ||||||
| Рис. 3.4. Строение цеолитов типа фожазита: а – тетраэдр; б – содалитовая клетка; в – суперклетка; г – элементарная ячейка |
|
Тетраэдры из оксидов кремния и алюминия расположены так, что цеолиты имеют открытые участки структуры. Это и создает систему пор с высокой удельной поверхностью. Химическую формулу первичной структурной единицы – тетраэдров кремния и алюминия можно представить в виде [2, 7]:
Тетраэдры с ионами Si4+ электрически нейтральны, а тетраэдры с ионами трехвалентного алюминия Al3+ имеют заряд минус единица, который нейтрализуется положительным зарядом катиона Ме+ (сначала катионом Na+, поскольку синтез чаще ведется в щелочной среде, затем в результате катионного обмена – катионами других металлов, катионом NH4+ или протоном Н+).
Наличие заряженных ионов алюминия на поверхности цеолита (центры Бренстеда) и обусловливает кислотные свойства и его каталитическую активность.
Натриевая форма цеолитов каталитически малоактивна и наименее термостабильна. Оба эти показатели существенно улучшаются при увеличении силикатного модуля цеолитов, а также степени ионного обмена на двухвалентные и на трехвалентные металлы. Среди них более термостабильны цеолиты типа ReY, обладающие высокой каталитической активностью. Благодаря этим достоинствам цеолиты серии ReY получили широкое применение в мировой нефтепереработке.
Алюмосиликатные катализаторы содержат химически связанную воду, участвующую в механизме катализа, полное удаление воды приводит к потере активности катализатора.
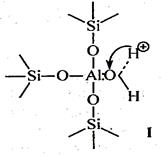
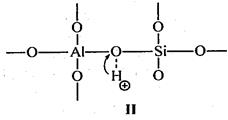
На поверхности алюмосиликатных катализаторов имеется два типа каталитических центров: протонные и апротонные (рис. 3.5) [11].
Протонные центры:
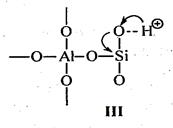
Апротонные центры:
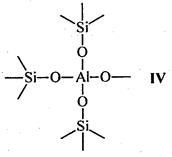
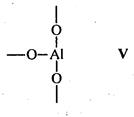
Рис. 3.5. Протонные и апротонные центры на поверхности алюмосиликатных катализаторов
С участием протонных центров алюмосиликатных катализаторов катализ осуществляется подвижными протонами. Протонные центры алюмосиликатных катализаторов содержат подвижные протоны либо воды, хемосорбированной координационно ненасыщенным атомом алюминия (структура I), либо гидрооксильных групп, сорбированных атомом алюминия (структура II), либо свободных протонов (структура III). Во всех этих структурах протон подвижен вследствие сильной поляризации связи О–Н за счет электроноакцепторных свойств координационного ненасыщенного атома алюминия.
На поверхности цеолитов поливалентных металлов также находятся как апротонные активные центры (координационно-ненасыщенные атомы алюминия), так и протонные активные центры. Дополнительно к протонным центрам, структура которых указана на рис. 3.5, в цеолитах поливалентных металлов имеются протонные центры, обусловленные протонизацией молекул воды, сорбированных катионами металла:
Ме+n · Н2О ↔ Ме+nОН·······Н+
Носителями каталитической активности в апротонных центрах являются координационно-ненасыщенные атомы алюминия с координационными числами 5, 4 или 3. Наиболее вероятно наличие атома алюминия с координационным числом 4 в алюмосиликатном тетраэдре AlO4 (структура IV). Вероятность существования атомов алюминия с координационным числом 3 мала (структура V) вследствие высокой активности таких атомов.
Протоны, входящие в состав протонных кислотных центров, взаимодействуют с молекулами углеводородов, превращая их в карбкатионы, которые подвергаются дальнейшим превращениям.
В апротонном центре координационно-ненасыщенный атом алюминия является акцептором электронов. В процессе хемосорбции электроны реакционноспособных центров молекул углеводорода переходят на вакантные орбитали координационно-ненасыщенных атомов алюминия. Образующиеся катион-радикалы углеводородов подвергаются дальнейшим превращениям (механизм см. ниже).
Вспомогательные добавки улучшают некоторые специфические физико-химические и механические свойства цеолитсодержащих алюмосиликатных катализаторов крекинга [2, 7]. Матрица и активный компонент – цеолит, входящий в состав катализатора, обладают только кислотной активностью. Для организации интенсивной регенерации закоксованного катализатора требуется наличие металлических центров, катализирующих окислительно-восстановительные реакции.
В качестве промоторов, интенсифицирующих регенерацию закоксованного катализатора, применяют платину (менее 0,1 % мас.), нанесенную непосредственно на цеолитсодержащий алюмосиликатный катализатор, или на окись алюминия с использованием как самостоятельной добавки. Применение промоторов окисления на основе Pt позволяет повысить полноту и скорость сгорания кокса катализатора и существенно понизить содержание СО в газах регенерации.
Дата добавления: 2020-08-31; просмотров: 1472;











