Пиролиз нефтяного сырья
Назначением процессов пиролиза является производство низших олефинов, преимущественно этилена, являющихся ценным сырьем (мономером) для синтеза важнейших нефтехимических продуктов. Пиролиз протекает при небольшом давлении ~ 0,1 МПа и температуре 700-900 ºС. Продолжительность процесса колеблется от долей секунды до 1,5-2 с в зависимости от вида сырья и температуры.
Процесс пиролиза в зависимости от целевого назначения может быть направлен на максимальный выход этилена (этиленовые установки), пропилена или бутиленов и бутадиена. Наряду с газом в процессе образуется пиролизная смола, содержащая моноциклические (бензол, толуол, ксилолы и др.) и полициклические (нафталин, антрацен и др.) углеводороды.
Получаемый при пиролизе этилен используется для производства оксида этилена, этилового спирта, полимеров (полиэтилена), стирола, пластмасс и др.
Пропилен является исходным мономером для производства оксида пропилена, полипропилена, акрилонитрила и бутадиена.
Смола пиролиза направляется на получение бензола и других ароматических углеводородов, нефтеполимерных смол, как компонент котельных топлив, сырье для производства технического углерода, пеков, высококачественных коксов и др.
Сырьем в процессах пиролиза служат газообразные и жидкие углеводороды: газы, легкие бензиновые фракции, газоконденсаты, рафинаты каталитического риформинга и реже керосино-газойлевые фракции. От сырья пиролиза зависят выходы продуктов. Наибольший выход этилена получается при пиролизе этана. По мере утяжеления сырья выход этилена снижается и увеличивается выход смолы пиролиза.
Принципиальная технологическая схема установки пиролиза бензина приведена на рис. 2.3 [2, 7].
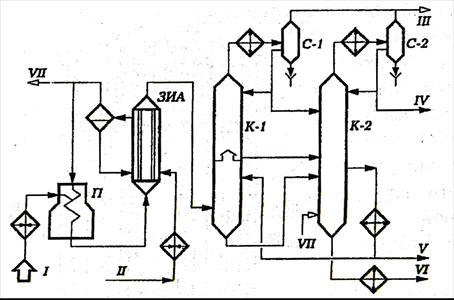
Рис. 2.3. Принципиальная схема установки пиролиза бензина:
аппараты: П – печь; ЗИА – закалочно-испарительный аппарат; К-1 – промывочная колонна; К-2 – ректификационная колонна; С-1 и С-2 – газосепараторы;
потоки: I – сырье; II – конденсат; III – газы пиролиза; IV – бензиновая фракция (н.к.-150 °С); V – легкая смола; VI – тяжелая смола; VII – водяной пар.
Сырьем установки служит фракция 62-180 °С прямогонного бензина и фракция 62-140 °С бензина-рафината каталитического риформинга. Предусмотрен также пиролиз этана и пропана с газофракционирующих установок (ГФУ).
Бензин после нагрева в теплообменниках подается в девять параллельно работающих трубчатых печей П (на схеме показана одна), а этан-пропановая фракция подается в десятую печь. На выходе из камеры конвекции в сырье вводится водяной пар в количестве 50 % мас. по бензину и 30 % мас. по этан-пропану. Температура на выходе из змеевиков печей 810-840 °С, продолжительность реакции 0,3-0,6 с. Продукты пиролиза далее поступают в трубы закалочно-испарительных аппаратов (ЗИА). Охлажденные до 400 °С пиропродукты затем направляются в низ промывочной колонны К-1, где при контакте с охлажденным квенчингом (фракцией 150-250 °С) охлаждаются до 180 °С и отмываются от твердых частиц углерода. Тяжелый конденсат с низа К-1 подается на ректификацию в колонну К-2.
Газы и пары, поднимающиеся из нижней части К-1, проходят полуглухую тарелку и подвергаются ректификации на верхних тарелках колонны. Конденсат с аккумулятора К-1 подается в колонну К-2. Выходящий с верха колонны К-1 пирогаз с парами легких фракций пироконденсата охлаждается в водяном холодильнике до 30 °С и поступает в газоконденсатор С-1. Легкий конденсат подается на орошение верха К-1 и на ректификацию в К-2. Выводимый с верха С-1 пирогаз подается на моноэтаноламиновую очистку и далее на ГФУ.
Из К-2 выводятся с установки пиробензин (фракция н.к.-150 °С), легкая смола (150-250 °С) и тяжелая смола (более 250 °С). Часть легкой смолы циркулирует в качестве квенчинга через колонну К-1.
Коксование
Сырье нефтяные остатки – гудроны, мазуты, смолы пиролиза, крекинг-остатки. Жесткий термический крекинг с целью получения дополнительного количества светлых фракций и нефтяного кокса.
Коксование тяжелых остатков или высокоароматизированных дистиллятов проводится при низком давлении около 0,5 МПа и температуре 510-550 °С с последующим нагреванием кокса в замедленном режиме до 620 °С, чтобы избежать закоксуемости змеевиков печи [5]. Выход светлых нефтепродуктов (бензина, керосина, газойля и др.) значительно увеличивается, если термический крекинг тяжелого сырья вести с получением большого количества кокса, в котором концентрируется углерод исходного сырья. При коксовании гудрона образуется 24 % кокса, 16 % бензина, 26 % керосиново-газойлевой фракции и 23 % тяжелого газойля. Все эти дистилляты нестабильны и нуждаются в облагораживании. Получаемый в процессе коксования бензин обладает низкой детонационной стойкостью.
Образуется газ (выход 10-20 %), содержащий непредельные углеводороды, в дальнейшем используется в процессах алкилирования и полимеризации.
Дистилляты коксования (выход 50-70 %) имеют невысокие эксплуатационные показатели из-за содержания непредельных и сернистых соединений. В дальнейшем подвергаются термокаталитической обработке и добавляются в товарные топлива.
2.4 Теоретические основы термических процессов
переработки нефтяного сырья
В термических, а также каталитических процессах нефтепереработки одновременно протекают как эндотермические реакции крекинга (распад, дегидрирование, деалкилирование, деполимеризация, дегидроциклизация), так и экзотермические реакции синтеза (гидрирование, алкилирование, полимеризация, конденсация) и частично реакции изомеризации с малым тепловым эффектом [7]. В продуктах термолиза (и катализа) нефтяного сырья содержатся углеводороды от низкомолекулярных до самых высокомолекулярных: от водорода и сухих газов до смолы пиролиза, крекинг-остатка и кокса.
Важные параметры процесса – температура, давление и время пребывания сырья в зоне высоких температур, что видно из уравнения Аррениуса [3]:
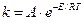 , (2.1)
, (2.1)
где k – константа скорости реакции;
А – коэффициент (фактор частоты столкновения молекул);
E – энергия активации, Дж/моль;
R – универсальная газовая постоянная, Дж/(моль·К);
T – температура, К.
Энергия активации реакций термического крекинга равна 210-
250 кДж/моль.
В процессе термолиза нефтяного сырья с повышением температуры термодинамическая вероятность протекания эндотермических реакций крекинга возрастает. В экзотермических реакциях синтеза наоборот, термодинамическая вероятность протекания реакций возрастает при понижении температуры. Реакции крекинга являются термодинамически высокотемпературными, а синтеза – термодинамически низкотемпературными [2, 7].
Аналогичный вывод вытекает и из принципа Ле-Шателье: повышение температуры способствует протеканию эндотермических реакций крекинга слева направо, а экзотермических реакций синтеза – в обратном направлении.
Для реакций, идущих с изменением мольности, т.е. объема системы, на состояние равновесия оказывает влияние не только температура, но и давление. Исходя из принципа Ле-Шателье следует, что повышение давления способствует реакциям синтеза, идущим с уменьшением объема. Наоборот, для реакций крекинга, идущих с увеличением объема, благоприятны низкие давления.
Для реакций изомеризации с малым тепловым эффектом, а также протекающих без изменения объема, температура и давление не оказывают влияние на их равновесие.
Для прогнозирования вероятности образования того или иного продукта реакций в термодинамике пользуются данными по энергиям связи в химических веществах.
Энергией связи называется количество энергии, необходимое для разрыва или образования определенного типа связи между атомами в молекулах. При возникновении связи происходит переход химической системы в более устойчивое состояние, сопровождающееся выделением тепла. Энергия образования связи положительна. При распаде молекул тепло поглощается, энергия разрыва связи отрицательна.
В табл. 2.1 сопоставлены результаты расчета с экспериментальными данными величины энергий разрыва связей в углеводородах [10]. Среднее арифметическое расхождение между результатами расчета и экспериментальными данными для 115 приведенных в табл. 2.1 связей составляет 3 кДж/моль.
Таблица 2.1
Расчетные и экспериментальные величины энергий разрыва
связей в углеводородах, кДж/моль
| № п/п | Связь | Расчет | Опыт |
| CH3 – H | 435 ± 4 | ||
| C2H5 – H | 410 ± 4 | ||
| C2H3 – H | 444 ± 13 | ||
| C2H –H | 502 ± 21 | ||
| HCCCH2 – H | 368 ± 17 | ||
| H2CCHCH2 – H | 360 ± 8 | ||
| н-С3Н7 – Н | 410 ± 8 | ||
| изо-С3Н7 – Н | 398 ± 4 | ||
| СН2СНСН(СН3) – Н | 343 ± 8 | ||
| н-С4Н9 – Н | 415 ± 8 | ||
| втор-С4Н9 – Н | 394 ± 4 | ||
| трет-С4Н9 – Н | 389 ± 8 | ||
| цикло-С5Н9 – Н | 394 ± 4 | ||
| (С2Н5)2СН – Н | 385 ± 8 | ||
| (СН3)3ССН2 – Н | 415 ± 4 | ||
| СН3 – цикло – С5Н9 | 348 ± 8 | ||
| СН3 – СН(С2Н5)2 | 335 ± 8 | ||
| СН3 – СН2С(СН3)3 | 356 ± 8 | ||
| СН3 – С6Н5 | 415 ± 17 | ||
| СН3 – цикло – С6Н11 | 352 ± 13 | ||
| СН3 – СН2С6Н5 | 301 ± 8 | ||
| С6Н5 – Н | 456 ± 13 | ||
| цикло-С6Н11 – Н | 394 ± 8 | ||
| С6Н5СН2 – Н | 356 ± 4 | ||
| СН3 – СН3 | 368 ± 8 | ||
| СН3 – С2Н | 469 ± 25 | ||
| СН3 – С2Н3 | 398 ± 17 | ||
| СН3 – С2Н5 | 356 ± 8 | ||
| СН3 – СН2CCH | 314 ± 21 |
Продолжение таблицы 2.1
| № п/п | Связь | Расчет | Опыт | |
| СН3 – СН2CHСН2 | 306 ± 13 | |||
| СН3 – СН2СН2СН3 | 356 ± 13 | |||
| СН3 – СН2(СН3)СН3 | 352 ± 8 | |||
| СН3 – СН(СН3)СНСН2 | 298 ± 13 | |||
| СН3 – СН2СН2СН2СН3 | 360 ± 13 | |||
| СН3 – СН(СН3)СН2СН3 | 348± 8 | |||
| СН3 – C(СН3)3 | 348 ± 8 | |||
| C2H3 – С6Н5 | 452 ± 25 | |||
| C2H3 – СН2С6Н5 | 343± 17 | |||
| C2H5 – C2H5 | 343± 8 | |||
| C2H5 – СН2CCH | 301 ± 21 | |||
| C2H5 – СН2CHСН2 | 293± 13 | |||
| C2H5 – СН2СН2СН3 | 343± 13 | |||
| C2H – С2Н | 548 ± 42 | |||
| C2H – C2H3 | 482 ± 33 | |||
| C2H – C2H5 | 456 ± 25 | |||
| C2H – СН2СН2СН3 | 452 ± 29 | |||
| C2H – СН(СН3)СН3 | 448± 25 | |||
| C2H – СН2СН2СН2СН3 | 456 ± 29 | |||
| C2H – С6Н5 | 507 ± 33 | |||
| C2H3 – C2H3 | 444 ± 25 | |||
| C2H3 – C2H5 | 385 ± 17 | |||
| C2H3 – СН2CHСН2 | 335 ± 21 | |||
| C2H3 – СН2СН2СН3 | 385 ± 21 | |||
| C2H3 – СН(СН3)СН3 | 381 ± 17 | |||
| C2H3 – СН2СН2СН2СН3 | 389 ± 21 | |||
| СН2CHСН2 – СН2CHСН2 | 243 ± 17 | |||
| СН2CHСН2 – СН2СН2СН3 | 293 ± 13 | |||
| СН2CHСН2 – СН(СН3)СН3 | 285 ± 13 | |||
| СН2CHСН2 – СН2СН2СН2СН3 | 297 ± 17 | |||
| СН2CHСН2 – СН(СН3) СН2СН3 | 281 ± 13 | |||
Продолжение таблицы 2.1
| № п/п | Связь | Расчет | Опыт |
| СН2CHСН2 – C(СН3)3 | 281 ± 13 | ||
| СН3СН2СН2 – СН2СН2СН3 | 343 ± 13 | ||
| C2H5 – СН(СН3)СН3 | 339 ± 8 | ||
| C2H5 –СН(СН3)СНСН2 | 280 ± 13 | ||
| C2H5 – СН2СН2СН2СН3 | 348 ± 13 | ||
| C2H5 – СН(СН3) СН2СН3 | 331 ± 8 | ||
| C2H5 – C(СН3)3 | 331 ± 8 | ||
| C2H5 – цикло – С5Н9 | 335 ± 8 | ||
| C2H5 – СН(С2Н5)2 | 318 ± 8 | ||
| C2H5 – СН2С(СН3)3 | 343 ± 8 | ||
| C2H5 – С6Н5 | 402 ± 17 | ||
| C2H5 – цикло – С6Н11 | 335 ± 13 | ||
| C2H5 – СН2С6Н5 | 289 ± 8 | ||
| CHCCH2 – СН2СН2СН3 | 297 ± 21 | ||
| CHCCH2 – СН2СН2СН2СН3 | 301 ± 25 | ||
| (СН3)2СН – СН2СН2СН2СН3 | 343 ± 13 | ||
| (СН3)2СН – СН(СН3) СН2СН3 | 327 ± 8 | ||
| (СН3)2СН – C(СН3)3 | 318 ± 8 | ||
| (СН3)2СН – СН(С2Н5)2 | 306 ± 8 | ||
| (СН3)2СН – СН2С(СН3)3 | 331 ± 8 | ||
| (СН3)2СН – С6Н5 | 394 ± 17 | ||
| СН3СН2СН2СН2 – СН2СН2СН2СН3 | 352 ± 8 | ||
| СН3СН2СН2 – СН(СН3)СН3 | 339 ± 13 | ||
| СН3СН2СН2 – СН(СН3)СНСН2 | 331 ± 13 | ||
| СН3СН2СН2 – СН2СН2СН2СН3 | 348 ± 17 | ||
| СН3СН2СН2 – C(СН3)3 | 331 ± 13 | ||
| СН3СН2СН2 – цикло – С5Н9 | 335 ± 13 | ||
| СН3СН2СН2 – СН(С2Н5)2 | 318 ± 13 | ||
| СН3СН2СН2 – СН2С(СН3)3 | 343 ± 17 | ||
| СН3СН2СН2 – С6Н5 | 402 ± 17 | ||
| СН3СН2СН2 – цикло – С6Н11 | 335 ± 17 |
Окончание таблицы 2.1
| № п/п | Связь | Расчет | Опыт |
| СН3СН2СН2 – СН2С6Н5 | 289 ± 13 | ||
| (СН3)2СН – CН(СН3)2 | 327 ± 8 | ||
| (СН3)2СН – СН(СН3)СНСН2 | 276 ± 13 | ||
| СН3СН2(СН3)СН – С6Н5 | 389 ± 17 | ||
| (СН3)3С – C(СН3)3 | 301 ± 8 | ||
| (СН3)3С – СН(С2Н5)2 | 297 ± 8 | ||
| (СН3)3С – СН2С(СН3)3 | 310 ± 8 | ||
| (СН3)3С – С6Н5 | 381 ± 17 | ||
| СН3СН2СН2СН2 – СН(СН3)СН2СН3 | 335 ± 13 | ||
| СН3СН2СН2СН2 – C(СН3)3 | 335 ± 13 | ||
| СН3СН2СН2СН2 – цикло – С5Н9 | 339 ± 13 | ||
| СН3СН2СН2СН2 – СН(С2Н5)2 | 322 ± 13 | ||
| СН3СН2СН2СН2 – СН2С(СН3)3 | 348 ± 13 | ||
| СН3СН2СН2СН2 – С6Н5 | 406 ± 21 | ||
| СН3СН2СН2СН2 – цикло – С6Н11 | 339 ± 17 | ||
| СН3СН2СН2СН2 – СН2С6Н5 | 293 ± 13 | ||
| СН3СН2(СН3)СН – СН(СН3)СН2СН3 | 314 ± 8 | ||
| СН3СН2(СН3)СН – C(СН3)3 | 310 ± 8 | ||
| СН3СН2(СН3)СН – СН(С2Н5)2 | 301 ± 8 | ||
| СН3СН2(СН3)СН – СН2С(СН3)3 | 322 ± 8 | ||
| (С2Н5)2СН – СН(С2Н5)2 | 289 ± 8 | ||
| (С2Н5)2 СН – СН2С(СН3)3 | 310 ± 8 | ||
| (СН3)2ССН2 – СН2С(СН3)3 | 343 ± 8 | ||
| С6Н5 – С6Н5 | 460 ± 25 |
При протекании деструктивных процессов происходит разрыв связей С–С и связей С–Н. Связь в молекуле углеводорода разрывается, если на ней сосредоточена энергия, равная или большая энергии образования связи. Энергия разрыва связи С–С изменяется при увеличении длины углеводородной цепи. Энергия разрыва связи С–Н зависит от характера углеродного атома – первичный, вторичный, третичный. Связи в молекулах углеводородов могут разрываться гомолитически и гетеролитически.
Гомолитический разрыв связей происходит при термических превращениях углеводородов, приводит к образованию свободных радикалов. Связь разрывается так, что у каждого осколка молекулы остается по одному электрону [11]:
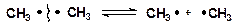

Радикалы – это свободные, кинетически независимые частицы, характеризующиеся наличием неспаренных электронов.
Гетеролитический разрыв связей происходит только при каталитических превращениях углеводородов, приводит к образованию ионов. Энергия активации таких реакций равна их тепловому эффекту. Связь разрывается так, что пара электронов связи целиком переходит к одному из атомов:
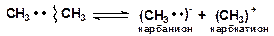
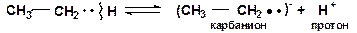
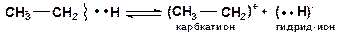
Гомолитический (радикальный) разрыв связей требует меньше энергии, чем гетеролитический (ионный) разрыв связей, при котором необходимо преодолеть электростатическое взаимодействие ионов. Например, в случае этана реакции [12]:


Затраты энергии гетеролитического распада по схеме 2 значительно выше, чем энергия гомолитического распада по схеме 1. Значения энергий активации этих реакций равны их тепловым эффектам
(Е1 = ∆Н1, Е2 = ∆Н2). Константы скорости образования радикалов и ионов соответственно будут равны:

При одинаковых предэкспоненциальных множителях (А1 = А2) соотношение скоростей реакций:
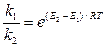 ,
,
и при температуре 600 ºС (873 К) составляет примерно 1050, т. е. распад на ионы совершенно ничтожен относительно распада на радикалы.
Углеводородные радикалы и ионы (атом водорода (Н·), гидрид-ион (Н··), протон (Н+), карбкатионы, карбанионы)  обладают высокой реакционной способностью, являются промежуточными частицами в термокаталитических процессах.
обладают высокой реакционной способностью, являются промежуточными частицами в термокаталитических процессах.
Важной характеристикой связи является энергия, необходимая для гомолитического ее разрыва, называемая энергией диссоциации связи. Энергия диссоциации связи равна энергии активации распада молекулы на радикалы, зависит от положения связи в молекуле углеводорода. В табл. 2.2 приведены усредненные значения энергий диссоциации некоторых связей С–С и С–Н, полученные различными методами (пиролиз, электронный удар, фотоионизация и др.) [11].
Таблица 2.2
Дата добавления: 2020-08-31; просмотров: 892;











