Алканы, циклоалканы
Предельные углеводороды в процессах термического переработки нефтяного сырья расщепляются как по связям С–С (реакция крекинга), так и по связям С–Н. Так как энергия диссоциации связи С–С меньше, чем связей С–Н, более вероятен распад С–С-связей. Энергия разрыва С-С-связи в молекулах всех классов углеводородов всегда ниже энергии С-Н-связи примерно на 50 кДж/моль.
При распаде по С–С-связи из молекулы алкана образуется непредельный углеводород – алкен и алкан меньшей молекулярной массы:
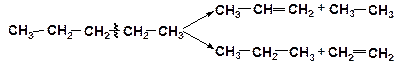
При распаде по С–Н-связям происходит дегидрирование алкана:
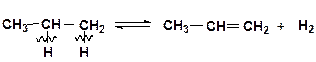
Для низших алканов (этан, пропан) реакция дегидрирования является преобладающей, так как число С–Н-связей значительно превышает число С–С-связей. Для высших алканов преобладают реакции крекинга.
Наиболее термически устойчив метан. В гомологическом ряду алканов с увеличением молекулярной массы термическая стабильность соединений снижается. Место разрыва в молекуле алкана определяется энергиями диссоциации связей, а также температурой и давлением. При умеренных температурах 400-500 ºС разрыв происходит ближе к середине молекулы, т.е. по наиболее слабым связям. Энергия разрыва связей С–Н и С–С наибольшая у концевых групп в молекулах, по мере приближения к центру молекулы энергия связи снижается и, начиная с 4-5 группы –СН2–, становятся постоянными. Например, в декане энергия связи изменяется следующим образом (в кДж/моль) [12, 13]:
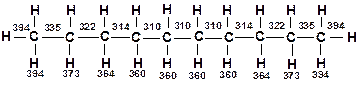
С повышением температуры может происходить разрыв и других связей. Уменьшение давления способствует разрыву ближе к концу молекулы, образуются продукты с большей упругостью пара, что находится в соответствии с принципом Ле-Шателье. При повышении давления место расщепления смещается к центру молекулы, образуются продукты с меньшей упругостью пара.
Изоалканы подвергаются крекингу несколько легче, чем алканы нормального строения. Связи между первичными атомами углерода всегда прочнее, чем С-С-связи в комбинациях с первичным, вторичным (СВТ) и третичным (СТР) атомами углерода. Энергия разрыва С-С-связи (DC-C) уменьшается в следующей последовательности:
DC-C > DC-Cвт > DС-Стр > DСвт-Свт > DСвт-Стр > DСтр-Стр.
В циклоалканах связь С–С несколько менее прочна чем в нормальных алканах: в циклогексановом кольце на 8 кДж/моль, в циклопентановом – на 25 кДж/моль [14]. В циклоалкановых кольцах прочность связей С–Н равна прочности связи СВТ –Н в алканах.
Алкены, алкины
В молекулах алкенов связи С–С и С–Н у атома углерода с двойной связью значительно прочнее, чем в молекулах алканов, а связи, сопряженные с двойной, т.е. находящиеся к ней в b-положении, сильно ослаблены относительно таких же связей в алканах. Двойная и тройная связь прочнее одинарной, но значительно меньше, чем в два или три раза.
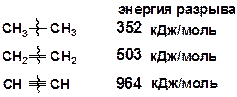
Энергия разрыва p-связи в этилене (тепловой эффект реакции) [14]:
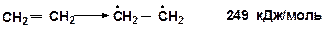
Если двойная связь – сопряженная, то энергия раскрытия p-связи меньше примерно на 60 кДж/моль. Например, для реакции крекинга дивинила тепловой эффект (прочность сопряженной p-связи) составляет:
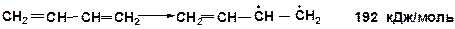
Арены
В молекулах ароматических углеводородов связи САР–САР;САР–Н и САР–С (САР – атом углерода, находящийся в ароматическом кольце) прочнее связей С–С и С–Н в алканах.
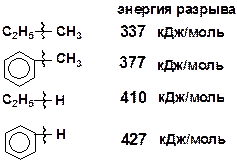
Сопряжение с ароматическим кольцом снижает прочность связей, т.е. наиболее ослаблены связи, находящиеся в b-положении относительно кольца.
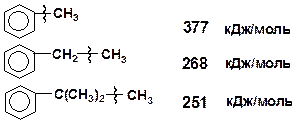
2.5 Химизм превращения углеводородов в процессах
термической переработки нефтяного сырья
Рассмотрим химизм и механизм превращения углеводородов различных классов. Реакции термического превращения углеводородов идут по радикально-цепному механизму, с разрывом преимущественно С–С-связей, в частности [3]:
· н-алканы рвутся по С–С-связям, по b-правилу и дают два радикала из которых крупный распадается с образованием радикала С1 или С2 и н-радикала, и дают газ и олефин;
- циклические углеводороды рвутся по С–С-связи в кольце и в боковой группе и далее реакции идут как у н-алканов;
· ароматические углеводороды в кольце не рвутся, а рвутся связи в боковой цепи между первым и вторым атомами углерода у кольца, после чего оторвавшаяся цепочка претерпевает те же реакции, что и н-алканы.
· Незамещенная ароматика конденсируется в дифенил.
Дата добавления: 2020-08-31; просмотров: 871;











