СТРУКТУРА И ФУНКЦИИ ИММУННОЙ СИСТЕМЫ 9 глава
У мышей с генетическим нокаутом по любому из генов ферментов, участвующих в перестройке ДНК антигенрецепторных молекул (иммуноглобулины, TCR), лимфоциты не развиваются совсем и имеется клинический синдром тяжёлой комбинированной иммунной недостаточности — ТКИН (англ. SСID — Severe Combined ImmunoDeficiency).
В результате данной реакции рекомбинации в непрерывную последовательность ДНК соединяются по одному сегменту из V–, D– и J–областей — этот процесс называют VDJ–рекомбинацией. Вся остальная ДНК V–, D– и J–областей вырезается и выбрасывается из генома в виде кольцевых ДНК. Поэтому приобретение B–лимфоцитом в начале своей дифференцировки специфичности по потенциальному Аг происходит раз и навсегда и строго необратимо на уровне ДНК.
В каждом отдельном B–лимфоците образуетсясвоя уникальная комбинация VDJ для тяжёлой цепи и VJ — для каждой из лёгких цепей. Таким образом и подсчитали возможное число вариантов АТ по антигенной специфичности, исходя из правил случайной комбинаторики. Для k–цепи из 40 V–сегментов и 5 J–сегментов может получиться 40´5 = 200 вариантов V–области k–цепи; для l–цепи — 30´4 = 120 вариантов; всего для лёгких цепей 320 вариантов; для тяжёлой цепи 50V´30D´6J = 9000 вариантов антигенсвязывающих областей тяжёлых полипептидных цепей. В цельной молекуле иммуноглобулинов разные лёгкие и тяжёлые цепи объединяются в тетрамер также случайным образом (по крайней мере теоретически). Число случайных сочетаний из 320 и 9000 — около 3´106.
Но это не всё, что обеспечивает разнообразие антигенсвязывающих областей АТ. Есть ещё два молекулярных процесса: запланированная неточностьсвязи сегментов V–D–J и запланированный гипермутагенезименно в V–генах иммуноглобулинов. Последнее свойство — гипермутагенез — отличает гены иммуноглобулинов даже от генов TCR: у TCR есть и комбинаторика сегментов, и неточность связи V–D–J, но не выявлен гипермутагенез.
Под неточностью связи V–D–J понимают тот факт, что при формировании этих связей происходит добавление лишних некодируемых наследуемым генетическим кодом нуклеотидов. Их два «сорта»: P–нуклеотиды и N–нуклеотиды. Нуклеотиды P (от Palindromic sequences — зеркальные последовательности) возникают на концах сегментов при вырезании одноцепочечных петлей ДНК и «достройки хвостов» ферментами репарации ДНК. Нуклеотиды N (от Nontemplate–encoded — нематрично кодируемые) пристраиваются к одноцепочечной ДНК после вырезания петли специальным ферментом лимфоцитов — терминальной дезоксинуклеотидилтрансферазой.Этот фермент достраивает от 1 до 20 дополнительных нуклеотидов, а ферменты репарации подстраивают комплементарные пары и лигируют (ковалентно продольно состыковывают) двухцепочечную «пристройку» ДНК с двухцепочечными P–нуклеотидами. Терминальная дезоксинуклеотидилтрансфераза экспрессируется недолго и на ранних стадиях дифференцировки B–лимфоцитов. Поэтому N–нуклеотиды характерны для тяжёлых цепей, поскольку гены тяжёлых цепей перестраиваются в первую очередь. Гены лёгких цепей перестраиваются во вторую очередь, в них N–нуклеотидов уже не находят.
«Платой» за эти попытки увеличить разнообразие Аг–связывающих областей АТ, таким образом, является то, что в 2/3 случаев добавление некодируемых нуклеотидов сдвигает рамку считывания в матричной РНК (мРНК) так, что трансляция белка становится невозможной. Это называют непродуктивной рекомбинацией генов иммуноглобулинов. Зато с учётом присоединения N– и P–нуклеотидов число пар V–генов от тяжёлой и лёгкой цепей достигает около 3500 и число вариантов антигенсвязывающих областей цельных молекул иммуноглобулинов, получающихся только в результате комбинаторики сегментов при перестройке ДНК, оказывается порядка 1013. Если учесть врождённые варианты V–, D– и J–сегментов, то мыслимое разнообразие и составляет около 1016, но реально меньше, так как в организме нет такого количества лимфоцитов.
Гипермутагенез, процесс возникновения точечных мутаций, происходит не под случайным воздействием космических частиц. Он запланирован и имеет место не во время лимфопоэза B–лимфоцитов в костном мозге, а во время иммуногенеза (т.е. после реально состоявшегося распознавания Аг и начавшегося иммунного ответа) и локализован в лимфоидных фолликулах периферических лимфоидных органов и тканей (лимфатических узлах, селёзенке, диффузных скоплениях). Именно гипермутагенез генов V–области иммуноглобулинов и отбор B–лимфоцитов по силе связи Ig–Рц с Аг являются механизмом возрастания аффинности АТ по мере прогрессивного развития так называемого вторичного иммунного ответа. Интенсивность гипермутаций в V–Ig в B–лимфоцитах оценивают как замену одного нуклеотида из 1000 на один митоз: каждый второй B–лимфоцит клона в зародышевом центре приобретает точечную мутацию в V–Ig. Для всей остальной ДНК явление точечной мутации реализуется с частотой на 9 порядков ниже, т.е. одна замена нуклеотида на 1012 пар нуклеотидов на митоз.
Процессы перестройки генов иммуноглобулинов в B–лимфоците отрегулированы так, что из двух родительских хромосом в конечном счёте в одном B–лимфоците будет использован только единственный вариант как лёгкой, так и тяжёлой цепи. Это явление называют аллельным исключением. А в организме в целом разнообразие удвоено — половина от матери, половина от отца.
Описанные генетические механизмы генерации разнообразия антигенсвязывающих областей АТ имеются у человека и мышей. У животных других видов есть иные молекулярные механизмы. Например, у птиц, а также у некоторых млекопитающих (кроликов, овец) нет разнообразия зародышевых сегментов в V–области. Поэтому первично перестроенные гены иммуноглобулинов одинаковы у всех незрелых B–лимфоцитов. Такие B–лимфоциты у птиц мигрируют из костного мозга в специализированный орган — сумку Фабрициуса, где они интенсивно пролиферируют. В процессе митозов в уже перестроенных генах V–области создаётся разнообразие по механизму, называемому конверсией генов: фрагменты ДНК из перестроенной V–области одной из гомологичных хромосом обмениваются на фрагменты из неперестроенной и ранее не использованной V–области второй из гомологичных хромосом. У овец, например, наибольший вклад в разнообразие антигенсвязывающих областей АТ вносят соматические мутации, и процесс их накопления локализован в пейеровых бляшках подвздошной кишки.
Структурные гены константных частей полипептидных цепей иммуноглобулинов расположены в тех же хромосомах, что и V–, D– и J–гены, «ниже по течению», т.е. к 3'–концу от J–сегментов. Для лёгких k- и l–цепей существует по одному C–гену — Сk и Сl. «Стыковка» нуклеотидного кода для V– и C–частей лёгких цепей происходит на уровне не ДНК, а РНК — по механизму сплайсинга первичного транскрипта РНК.
Для каждого изотипа иммуноглобулинов есть свой отдельный C–ген. У человека такие гены расположены в следующем порядке, считая от J–сегмента к 3'–концу: Сm, Сd, Сg3, Сg1, eСe (псевдоген e–цепи), Ca1, Cg2, Cg4, Сe, Сa2; у мыши: Сm, Сd, Сg3, Cg1, Cg2b, Cg2a, Сe, Сa.
Завершившие лимфопоэз B–лимфоциты любого клона по антигенной специфичности (специфичности V–области иммуноглобулина) экспрессируют иммуноглобулины только классов M и D (IgM и IgD). При этом мРНК транскрибируется в виде непрерывного транскрипта с перестроенных генов VDJ и Сm–Cd. При этом ДНК остальных C–генов других изотипов цела и невредима. В результате альтернативного сплайсинга первичного транскрипта РНК образуются мРНК отдельно для тяжёлых цепей IgM и IgD, которые и транслируются в белок. Этим процессом заканчивается полноценный лимфопоэз B–лимфоцитов.
Переключение же на синтез иммуноглобулинов других изотипов — G, Е, А (IgG, IgE, IgA) происходит уже в процессе развития иммунного ответа, т.е. после распознавания Аг и под воздействием определённых (в значительной мере известных на сегодня) цитокинов T–лимфоцитов и молекул клеточной мембраны T–лимфоцитов (CD40L). Существенно, что такое переключение идёт опять по механизму рекомбинации ДНК: в ДНК к ранее и единожды перестроенной комбинации VDJ присоединяется какой–либо один из C–генов тяжёлой цепи (либо Сg1, либо Сg2, либо Сg3, либо Сg4, либо Сe, либо Сa1, либо Сa2).
ДНК неиспользованных C–генов слева от использованного C–гена на этом этапе развития B–лимфоцита элиминируется в виде кольцевых структур. С этого момента судьба B–лимфоцита определена как по единственной антигенной специфичности, так и изотипу тяжёлой цепи. Если из окружения продолжают поступать регулирующие переключение изотипов сигналы, то возможен ещё акт переключения на изотип, C–ген которого «правее» в ДНК от уже экспрессированных C–генов. Если с инструкциями «покончено», B–лимфоцит вступает в терминальный этап своего развития: он становится плазматической клеткой — продуцентом больших количеств моноклонального секретируемого иммуноглобулина.
При переключении изотипа тяжёлой цепи ДНК разрывается по так называемым областям переключения SR (Switch Region), расположенным в интронах перед каждым C–геном (за исключением Сd). SR перед Сm состоит из 150 повторов последовательности [(GAGCT)3–7 (GGGGGT)]. SR перед другими C–генами отличаются в деталях, но во всех из них содержатся повторы GAGCT и GGGGGT. При переключении изотипов с ДНК работают физически другие ферменты, чем при рекомбинации VDJ (см. рис. 4.5).
Молекулы иммуноглобулина одной и той же специфичности по Аг присутствуют в организме в двух физических состояниях — в растворе и на мембране клеток и в 3 формах:
· в растворимой форме в крови и других биологических жидкостях (секретируемый клеткой иммуноглобулин);
· на мембране B–лимфоцита в составе Рц B–лимфоцитов для Аг — BCR (B–cell receptor) (трансмембранная форма иммуноглобулина). Трансмембранные формы всех классов иммуноглобулинов, включая IgM и IgA, мономеры;
· в связи с клетками, но не в трансмембранном варианте, а связанным за Fc–конец Fc–Рц клетки. В свободном виде только IgE способны быть связанными с FceRI на тучных клетках, базофилах, дендритных клетках и некоторых других типах клеток. Для остальных изотипов иммуноглобулинов характерна фиксация на Fc–Рц (FcR) на клетках только после связывания АТ с Аг, т.е. фиксируется не свободное АТ, а комплекс «Аг–АТ» через Fc–конец молекулы иммуноглобулина (на макрофагах, нейтрофилах, эозинофилах).
Возвращаясь к трансмембранной и секретируемой формам иммуноглобулинов, отметим, что они различаются по своему C–концу тяжёлых цепей: в трансмембранной форме у тяжёлых цепей молекулы есть лишние 25 остатков гидрофобных АК, которые «заякоревают» молекулу в фосфолипидном бислое мембраны. Трансмембранная и секретируемые «версии» тяжёлых цепей кодируются разными экзонами соответствующих C–генов. В данном случае экзонами называют структурные гены каждого из отдельных доменов полипептидной цепи. Последний экзон каждого C–гена содержит последовательности нуклеотидов для кодирования трансмембранного участка молекулы. Первичный транскрипт РНК дифференцирующего B–лимфоцита содержит все экзоны C–гена. Трансляция белка с полноразмерной мРНК обеспечивает биосинтез тяжёлых цепей для трансмембранной формы. Но последний экзон может быть легко удалён из первичного транскрипта РНК, и тогда будет транслироваться секретируемая форма иммуноглобулина. В зрелых плазмоцитах трансмембранная форма уже совсем не синтезируется, а только продуцируется секретируемая форма.
4.5. Изотипы, аллотипы и идиотипы иммуноглобулинов
В классической серологии для характеристики иммуноглобулинов используют не только понятие изотипа, но и такие понятия, как аллотипыи идиотипыконкретных молекул иммуноглобулинов. Эти понятия обусловлены различиями между молекулами иммуноглобулинов, которые можно выявить по реакции данных белков с АТк ним. Для этого лабораторных животных иммунизируют так или иначе выделенными препаратами иммуноглобулинов и получают антисыворотки.
Во-первых, существует легко выявляемая с помощью антисывороток общность иммуноглобулинов одного изотипа у всех особей данного вида животных (видовая антиклассовая/подклассовая или антиизотипическая специфичность), т.е. изотипамииммуноглобулинов называют варианты классов и подклассов (вместе взятые) иммуноглобулинов по тяжёлым цепям. У человека есть 9 изотипов: М (IgM), G1 (IgG1), G2 (IgG2), G3 (IgG3), G4 (IgG4), A1 (IgA1), А2 (IgA2), E (IgE), D (IgD). Но отдельные особи одного вида продуцируют несколько отличающиеся варианты иммуноглобулинов в пределах одноимённого изотипа — это аллельные варианты, или аллотипы, иммуноглобулинов. Факт существования аллотипов свидетельствует о некотором генетическом полиморфизме внутри вида по локусам C–генов как лёгких, так и тяжёлых цепей.
Антисыворотки против уникальных вариабельных участков молекул иммуноглобулинов называют антиидиотипическими, а соответствующие эпитопы в молекуле АТ — идиотипомАТ— (idious — уникальный; не такой, как другие). Таким образом, идиотип АТ — это вариант уникального антигенсвязывающего участка молекулы иммуноглобулина.
Перечислим свойства иммуноглобулинов (человека) разных классов (табл. 4.2).
Таблица 4.2. Свойства человеческих иммуноглобулинов
| IgG1 | IgG2 | IgG3 | IgG4 | IgM | IgA1 | IgA2 | IgD | IgE | |
| Свойство | Тяжёлая цепь | ||||||||
| | | | | | | | | | |
| Мол. масса, | |||||||||
| Концентрация в сыворотке крови, мг/мл | 0,5 | 1,5 | 0,5 | 0,03 | 3x10-5– 5x10-5 | ||||
| Время полураспада в крови, сут | |||||||||
| Активация комплемента по классическому пути | + | + | +++ | – | ++++ | – | – | – | – |
| Связывание с Fc–Рц фагоцитов | +++ | – | + | – | – | – | – | – | + |
| Связывание с Fc | – | – | – | – | – | – | – | – | +++ |
| Способность нейтрализовать инфекционность вирусов и бактерий | + | + | + | + | + | + | + | – | – |
| Секреция через эпителий слизистых оболочек | | | | | + | +++ | +++ | – | +++ |
| Проникновение через плаценту | +++ | +++ | +++ | +++ | – | – | – | – | – |
Примечание. Количественная выраженность того или иного свойства в данном случае представлена в условных знаках: «–» — отсутствие; «+» — немного; «++» — больше, чем «+"; «+++» — больше, чем «++».
Низкие концентрации, например, IgA в крови не означают, что организм продуцирует IgA меньше, чем IgG. Скорее наоборот: суточная продукция IgA возможно максимальна среди прочих изотипов и составляет около 3 г, но его физиологическое место не в крови, он секретируется из внутренней среды во внешнюю — в слизистые экзосекреты и таким образом является фактором специфической иммунной защиты внутренней среды, вынесенным во внешнюю за пределы покровных тканей. Кстати, в работах последних лет появились данные, свидетельствующие о том, что и иммуноглобулины другого изотипа — IgE — более чем на 90% секретируются в слизистый экзосекрет ЖКТ.
4.6. Дифференцировка B–лимфоцитов
Дифференцировка B–лимфоцитов из общей лимфоидной клетки–предшественницы — потомка стволовой кроветворной клетки состоит из следующих этапов и процессов.
· Развитие молекулярно–генетического аппарата, обеспечивающего биосинтез иммуноглобулинов — это перестройка генов иммуноглобулинов (обеспечивающая разнообразие антигенсвязывающих областей иммуноглобулинов) и настройка этих генов на продуктивную интеграцию в клеточный метаболизм;
· Экспрессия генов молекул, обеспечивающих проведение сигнала с иммуноглобулинового Рц для Аг внутрь клетки;
· Экспрессия генов мембранных молекул, необходимых для участия B–лимфоцита во взаимодействиях с другими клетками, в первую очередь с T–лимфоцитами и фолликулярными дендритными клетками. Это молекулы CD40, MHC–II, CD45, Рц для цитокинов–факторов роста (ИЛ–7 во время лимфопоэза, ИЛ–2 во время иммуногенеза);
· Для эффективного функционирования B–лимфоцитов существенна экспрессия на мембране корецепторов CD19, CD20 и CD21. Не случайно именно эти мембранные молекулы используют как маркёры для определения содержания B–лимфоцитов лабораторными методами идентификации клеток.
Прежде чем описать последовательность событий дифференцировки B–лимфоцитов, скажем о существовании двух известных на настоящее время субпопуляций B–лимфоцитов — B1 и B2. B2–лимфоциты — это те лимфоциты, про которые знали раньше. B1–лимфоциты стали известны относительно недавно и «проявили» они себя при детальных анализах определённых клинических случаев лейкозов. B1–лимфоциты несут мембранный маркёр, которого нет на B1–лимфоцитах, — это молекула CD5. Та же молекула экспрессируется и на некоторой части T–лимфоцитов.
B1–лимфоциты поддерживают свою физиологическую регенерацию в течение всей жизни из отдельной клетки–предшественницы, пул которой у взрослых не пополняется за счёт общей стволовой кроветворной клетки костного мозга. Эта отдельная клетка–предшественница отселяется из кроветворной ткани на свою анатомическую территорию — в брюшную и плевральную полости — ещё в эмбриональном периоде. Итак, место обитания B1–лимфоцитов — прибарьерные полости. B1–лимфоциты значительно отличаются от B2–лимфоцитов по антигенраспознавательным способностям продуцируемых АТ. АТ, синтезированные B1–лимфоцитами, не имеют значительного разнообразия вариабельных участков молекул иммуноглобулинов, но, напротив, ограничены в репертуаре распознаваемых Аг, и эти Аг — наиболее распространённые соединения клеточных стенок бактерий. Все B1–лимфоциты — как бы один не слишком специализированный, но определённо ориентированный (антибактериальный) клон. АТ, продуцируемые B1–лимфоцитами, почти исключительно IgM, переключение классов иммуноглобулинов в B1–лимфоцитах не «предусмотрено». Таким образом, B1–лимфоциты — «отряд» противобактериальных «пограничников» в прибарьерных полостях, предназначенных для быстрой реакции на «просачивающиеся» через барьеры инфекционные микроорганизмы из числа широко распространённых. В сыворотке крови здорового человека преобладающая часть иммуноглобулинов — продукт синтеза как раз B1–лимфоцитами, т.е. это относительно полиспецифичные иммуноглобулины антибактериального назначения.
B2–лимфоциты — это лимфоциты, характеризующиеся широким разнообразием антигенраспознающих участков молекул продуцируемых ими иммуноглобулинов. Они проходят свой лимфопоэз в раннем эмбриогенезе на территории печени, затем исключительно на территории костного мозга, а свой иммуногенез — строго в фолликулах периферических лимфоидных органов.
В лимфопоэзе B2–лимфоцитов выделяют 6 этапов: [общая лимфоидная клетка–предшественница] ® ранняя про–B–клетка ® поздняя про–B–клетка ® большая пре–B–клетка ® малая пре–B–клетка ® незрелая B–клетка ® зрелая неиммунная B–клетка (выходит из костного мозга в периферическую лимфоидную ткань).
Клетки стромы костного мозга обеспечивают оседлость развивающихся B–лимфоцитов за счёт взаимодействия определённых молекул межклеточной адгезии и факторы роста для необходимого числа циклов пролиферации. Как и во всех случаях клеточной дифференцировки, самые ранние механизмы коммитации к данному пути, а не к другому, неизвестны. Но рад маркёров движения по пути B–лимфопоэза известны.
На ранней лимфоидной клетке–предшественнице экспрессируются несколько молекул адгезии, обеспечивающих оседлость в течение необходимого периода времени в костном мозге, среди них VLA–4 (Very Late Antigen–4 — очень поздний Аг 4), лигандом которого на клетках стромы является VCAM–1 (Vascular Cell Adhesion Molecule–1 — молекула адгезии 1 к стенке сосуда). На ранней про–B–клетке, кроме молекул адгезии, экспрессируется Рц c–kit (CD117) для первого фактора роста — мембранной молекулы клеток стромы SCF — стволовоклеточного фактора. Это взаимодействие обеспечивает надлежащее число митозов ещё не поделённых на клоны по Рц для Аг предшественников B–лимфоцитов.
На следующей стадии — поздней про–B–клетке — экспрессируется Рц для ИЛ–7, воспринимающий секретируемый теми же клетками стромы цитокин ИЛ–7. Выявлен и ещё один цитокин, продуцируемый клетками стромы костного мозга, нокаут гена которого полностью отменяет развитие B–лимфоцитов — это SDF–1. Данные взаимодействия поддерживают пролиферацию про–B– и больших пре–B–клеток, в которых уже произошла перестройка генов тяжёлой цепи, но ещё не было перестройки генов лёгкой цепи. Таким образом накапливаются «полуклоны» B–лимфоцитов с уже известной специфичностью по тяжёлой цепи, но ещё неизвестной — по лёгкой. Это тоже механизм приумножения разнообразия Аг–связывающего репертуара цельных молекул иммуноглобулинов: с одной и той же тяжёлой цепью будут сочетаться в пары разные варианты будущих лёгких цепей.
Главные события дифференцировки B–лимфоцитов — перестройка генов иммуноглобулинов — начинаются на стадии ранней про–B–клетки с перестройки D–J в генах тяжёлых цепей, причём на обеих гомологичных хромосомах. В поздней про–B–клетке происходит рекомбинация ДНК V–DJ сначала на одной из гомологичных хромосом. Если она окажется непродуктивной, то та же попытка делается на второй гомологичной хромосоме. В случае продуктивной перестройки на первой хромосоме вторая использована не будет.
На следующей стадии в пре–B–клетке происходит перестройка V–J–лёгких цепей, причём сначала одной из цепей — k или l, на одной из гомологичных хромосом. Если не получится продуктивная перестройка с первой попытки в случае лёгких цепей, предпринимаются следующие.
Клетки, в которых не получилось ни одной продуктивной перестройки в генах тяжёлых и лёгких цепей, погибают по механизму апоптоза — явления, весьма распространённого для лимфоцитов.
4.7. Рецептор B–лимфоцитов для антигена (BCR)
Экспрессия на поверхности клетки продуктов перестроенных генов иммуноглобулинов, кроме того, что является главным «опорным» параметром конечной цели всей дифференцировки B–лимфоцитов, в динамике служат ещё и решающими ориентирами процесса развития этих клеток.
Собственно связывание Аг — функция вариабельных доменов димера из тяжёлой и лёгкой цепей иммуноглобулина во всех физических состояниях молекулы этого белка, но чтобы быть Рц для Аг на клетке «чистой» молекулы иммуноглобулина мало. Кроме того, что мембранная форма иммуноглобулина имеет дополнительный гидрофобный трансмембранный участок полипептида в тяжёлых цепях, в формировании BCR участвуют ещё два обязательных полипептида, называемые (неудачно) Iga (CD79a) и Igb (CD79b). Шесть полипептидных цепей BCR показаны на рис. 4.6. Дело в том, что собственный цитоплазматический участок трансмембранной формы тяжёлых цепей состоит из остатков 3 АК. Этого мало, чтобы иметь эффективные связи с внутриклеточной метаболической «машиной». Рц же по определению не только воспринимает сигнал (физически связывает лиганд), но и проводит его внутрь клетки. Так вот компоненты BCR Iga и Igb своими цитоплазматическими участками молекулы связаны с внутриклеточными тирозинкиназами, что и обеспечивает проведение сигнала от связывания Аг внутрь клетки, чтобы та могла изменить свой метаболизм в соответствии с внешними запросами. В цитоплазматических участках Iga и Igb присутствуют характерные последовательности остатков АК, называемые иммунорецепторными тирозинсодержащими активирующими последовательностями(ITAM — Immunoreceptor Tyrosine–based Activation Motifs); ITAM впервые открыты именно в Iga и Igb. Такие же последовательности присутствуют в проводящих сигнал компонентах Рц T–клеток для Аг. Таким образом, известно, что первой биохимической реакцией активации внутриклеточных процессов после связывания Рц Аг является фосфорилирование остатков тирозина в ITAM.
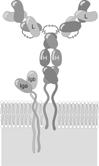
Рис. 4.6. Строение рецептора B–лимфоцита для антигена.
Iga и Igb имеют по одному внеклеточному домену, которым они прочно нековалентно связаны с тяжёлыми цепями иммуноглобулинового компонента BCR. Экспрессия Iga и Igb начинается на стадии про–B–клетки и поддерживается в течение всего онтогенеза B–лимфоцита до самой терминальной стадии — плазмоцита, на котором экспрессия BCR прогрессивно уменьшается до полного исчезновения.
Для того чтобы произошла эффективная активация B–клетки через BCR, необходима перекрестная сшивка Аг нескольких BCR. Для этого молекула Аг должна иметь повторяющиеся эпитопы на своей поверхности. Дальнейшие события активации B–лимфоцита показаны на рис. 4.7.
Выявлены 4 тирозинкиназы, ассоциированные с BCR: Fyn, Btk, Lyn и Syk. Сначала первые 3 обеспечивают фосфорилирование двух остатков тирозина в ITAM Iga и Igb. К фосфорилированным тирозинам присоединяется и тем активируется к действию Syk, продолжающая активационный каскад. Тирозинкиназы активируются в результате фосфорилирования в одном месте и ингибируются в результате тоже фосфорилирования, но в другом месте молекулы: так устроено, чтобы процесс активации клетки не принимал характера «вразнос».
Для активации необходимо дефосфорилирование ингибирующих участков молекул тирозинкиназ. Такое дефосфорилирование катализирует мембранная тирозинспецифичная фосфатаза CD45. Эта молекула имеет несколько изоформ, экспрессирована на всех белых клетках крови, поэтому её название — общий Аг лейкоцитов.
Внутри клетки действует ещё одна фосфатаза — SHP, которая дефосфорилирует активационные тирозины, чем ограничивает процесс активации лимфоцита. Мыши, у которых этот фермент отсутствует по причине мутации, реагируют на существенно меньшие дозы Аг, чем нормальные мыши, у них необыкновенно повышен уровень пролиферации лимфоцитов, и эти мыши умирают через несколько недель после рождения с клинически признаками разлитой аутоиммунной патологии.
Тирозинкиназа Syk активирует фосфолипазу C–g (PLC–g) и Ras. Ras в свою очередь активирует киназу Raf, которая фосфорилирует внутриклеточные белки по остаткам серина или треонина, что вносит свой вклад в активацию ДНК–связывающих белков и тем самым способно инициировать транскрипцию.
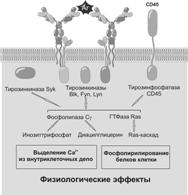
Рис. 4.7. Активация B–лимфоцита: внутриклеточная передача «сигнала».
Фосфолипаза C–g катализирует превращение фосфатидилинозитола бифосфата на диацилглицерол (ДАГ) и фосфатидилинозитол трифосфат (PIP3). ДАГ активирует протеинкиназу С — серин/треонинкиназу, которая начинает фосфорилировать белки по остаткам серина или треонина, что, как и при работе Raf, заканчивается активацией транскрипции. PIP3 стимулирует повышение в клетке концентрации ионов Ca2+. В результате активируются кальций–зависимые ферменты, что также действует в направлении активации транскрипции.
Дата добавления: 2016-07-18; просмотров: 2666;











