СТРУКТУРА И ФУНКЦИИ ИММУННОЙ СИСТЕМЫ 8 глава
· Глава 4
АНТИТЕЛА. B–ЛИМФОЦИТЫ
Антитела (АТ)стали первой «иммунологической материей», которую открыли для себя современные люди. Точнее говоря, был открыт феномен специфического противодействия ядам со стороны сыворотки крови животных. Впервые белок иммуноглобулиновой природы был выделен из тела человека Бенс-Джонсом в 1848 г., хотя автор ничего ещё не знал об АТ. Кстати, последний из известных изотипов иммуноглобулинов — IgE — был выделен 100 лет спустя независимо шведскими и японскими учёными в 1960 г.
Впервые термин «антитоксическая сыворотка» ввели Эмиль Беринг и Китасато Cибасабуро в 1890 г. для обозначения открытого ими феномена нейтрализации токсических свойств дифтерийного токсина сывороткой крови животных, переболевших дифтерией и выздоровевших.
В 1891 г. термин «антитоксин» использовали итальянские исследователи Д. Тиццони и Д. Каттани применительно к неким факторам, которые появляются в сыворотке крови животного после введения ему несмертельных доз токсина возбудителя столбняка. Эти факторы способны нейтрализовать повреждающее действие токсина. Кроме феномена нейтрализации токсических свойств, эти исследователи эмпирическим путём нашли способ «дотронуться» до антитоксинов руками: они сумели осадить антитоксин из цельной сыворотки сульфатом магния. На основании этого биохимического свойства в первой же работе антитоксины правильно были отнесены к белкам и, более того, к белкам–глобулинам. И в наши дни самая первая и доступная методика по выделению иммуноглобулинов — осаждение солями серной кислоты (сульфатом аммония, сульфатом натрия).
В том же 1891 г. в статье П. Эрлиха появился термин «АТ». Первооткрыватели точно поняли суть наблюдаемого явления: организм при контакте с вредными внешними веществами способен вырабатывать особые собственные вещества, предназначенные для избирательного (специфического) связывания попавшего в организм внешнего вещества. Вот эти-то собственные «спасительные» вещества и называли АТ. Семантически этот термин на первый взгляд не очень корректен,ибо АТ в большинстве ситуаций предназначены для защиты собственного тела, а не для антительного действия. Но в понимании П. Эрлиха «тела» — это не собственное тело, а те внешние субстанции, которые попадают в организм, и с 1899 г. с работ Л. Детре (сотрудника И.И. Мечникова) и до сих пор называют антигенами. Термин «антиген» логически также небезупречен, поскольку далеко не все, что распознаёт иммунная система, направлено против (анти) собственного генома, более того, часть — и не малая — является продуктами собственного генома.
Поэтому Аг следует понимать, как любое вещество, которое потенциально может быть распознано иммунной системой организма.
4.1. Антитела
Антитела (АТ) — это особые растворимые белки с определённой биохимической структурой (иммуноглобулины), которые присутствуют в сыворотке крови и других биологических жидкостях и которые организм вырабатывает для связывания разнообразных Аг.
Cуществуют весьма серьёзные эволюционные генетические ограничения в отношении того, что может, а что не может быть Аг для данного организма, но соответствующие гены экспрессируются в основном не в лимфоцитах, т.е. за пределами собственно иммунной системы как таковой.
АТ были предметом подробного изучения классической биохимии 50–70-х годов. Фундаментальными признаны работы лауреата Нобелевской премии Родни Портера по исследованию биохимических свойств и вторичной структуры молекул АТ. Все без исключения АТ принадлежат к одному типу белковых молекул, имеющих глобулярную вторичную структуру, поэтому и назван этот тип молекул иммуноглобулинами. Первая работа по электрофорезу белков сыворотки опубликована Арне Тизелиусом в 1937 г. Все АТ — иммуноглобулины. Строго говоря, утверждать обратное некорректно. Нельзя сказать, что все иммуноглобулины — АТ. Термин АТ применим только к иммуноглобулину, для которго известен соответствующий Аг.
Международная аббревиатура иммуноглобулинов — Ig. Заглавная латинская буква справа от Ig обозначает один из 5 существующих у млекопитающих классов иммуноглобулинов — М, G, А, Е, D, последующая арабская цифра обозначает подкласс. Подклассы есть только у иммуноглобулинов классов G (G1, G2, G3, G4) и A (A1, A2). Классы и подклассы, вместе взятые, называют изотипами иммуноглобулинов. Таким образом, изотипов 9. Пять классов иммуноглобулинов имеются только у млекопитающих, но зато у всех видов млекопитающих гомологичны все эти 5 классов. Это говорит о том, что 5 классов иммуноглобулинов сложились в эволюции до появления млекопитающих. То, что они столь консервативно сохранились при дивергентной эволюции, свидетельствует об оптимальности их биологических свойств и необходимости для выживания в условиях земной природы.
4.2. Структура молекул иммуноглобулинов
В 1959 г. Родни Портер подверг IgG кролика протеолизу под действием фермента папаина и в результате получил разделяемые ионообменной хроматографией три фрагмента. Два из них были одинаковыми и сохраняли способность связывать Аг, поэтому автор обозначил их Fab–фрагмент (Fragment, Antigen Binding — связывающий Аг фрагмент). Третий фрагмент отличался от первых двух и имел свойство легко кристаллизоваться, он был обозначен как Fc–фрагмент (Fragment, Crystallizable — кристаллизующийся фрагмент). Впоследствии стало известно, что Fc–фрагменты иммуноглобулинов в пределах одного изотипа у данного организма строго идентичны независимо от специфичности АТ по Аг. За эту инвариантность их стали называть константными — Fc–фрагмент (Fragment, Constant — константный фрагмент, аббревиатура удачно совпала).
В 1961 г. Джеральд Эдельман с М.Д. Поуликом сумели диссоциировать цельные молекулы АТ на отдельные белковые цепи. Они выяснили, что цепи ассоциированы между собой дисульфидными связями. В 1962 г. Родни Портер предложил схему строения молекул иммуноглобулинов, которая оказалась совершенно верной: 4 полипептидные цепи — пара одинаковых тяжёлых плюс пара одинаковых лёгких. Тяжёлые цепи обозначают буквой «Н» (от Heavy — тяжёлый), лёгкие — буквой «L» (от Light — лёгкий). Принципиальная схема строения молекул иммуноглобулинов приведена на рис. 4.1.
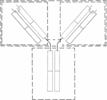
Рис. 4.1. Принципиальная схема строения молекул иммуноглобулинов. 1 — антигенсвязывающие центры молекулы иммуноглобулина; 2 — лёгкие цепи (L); 3 — тяжёлые цепи (Н); 4 — шарнирная область; 5 — Fab–фрагмент; 6 — (Fàb)2–фрагмент; 7 — Fc–фрагмент.
H–цепь IgG состоит из 450 остатков АК и имеет относительную молекулярную массу около 50 тыс., а лёгкая цепь — из 212 остатков АК и имеет молекулярную массу около 25 тыс. Общая относительная молекулярная масса молекулы IgG составляет 150 тыс.
Антигенсвязывающие домены обеих цепей имеют сильно варьирующий АК–состав (поэтому и способны связывать разные Аг). Поэтому эти участки (или области) молекулы — как Н-, так и L–цепи называют вариабельными и обозначают буквой «V» (Variable Region — вариабельный участок). Внутри вариабельных участков выделяют и гипервариабельные. V–область занимает один домен в H–цепи и один домен в L–цепи. Все, что «ниже» вариабельных участков, имеет строго инвариантный для каждого изотипа иммуноглобулинов АК–состав, и эту часть молекулы называют C–областью (от Constant Region). Соответствующие домены в полипептидных цепях называют C–доменами. В тяжёлой цепи 3 или 4 C–домена: СН1, СН2, СН3, СН4. В лёгкой цепи один C–домен, обозначаемый как CL.
Fc–фрагменты молекул иммуноглобулинов (разные у различных изотипов, но тождественные в пределах изотипа) обеспечивают разное взаимодействие комплексов Аг–АТ по санирующим деструктивным механизмам, способным расщепить и вывести Аг из организма — с системой комплемента, фагоцитами, эозинофилами, базофилами, тучными клетками. Каждый класс иммуноглобулинов специализирован по вступлению во взаимодействие (найму) с определёнными «исполнителями» деструкции Аг (лейкоцитами или системой комплемента).
Следующий фундаментальный этап в исследовании АТ — работы Г. Кёлера и Ц. Мильштейна, которые в 1974–1975 гг. применили метод гибридизации соматических клеток к антителообразующим B–лимфоцитам и открыли технологию получения моноклональных АТ. Им присуждена Нобелевская премия в 1984 г. Всемирно признано беспрецедентное прикладное значение этой работы. Но велик и её фундаментальный смысл. Она стала идеальным экспериментальным доказательством всеобщности клональности биосинтеза иммуноглобулинов в B–лимфоцитах, что точно соответствует клонально–селекционной теории (гипотезе) устройства лимфоцитарного иммунитета вообще, выдвинутой Фрэнком Бёрнетом, также лауреатом Нобелевской премии 1960 г. Бёрнет опубликовал свою гипотезу в 1957 г. и сам рассматривал её как развитие теории Нильса Йерне о моноспецифичности антителообразующих клеток.
АТ синтезируют только и исключительно B–лимфоциты. Ниже будет показан генетический механизм дифференцировки B–лимфоцитов и биосинтеза иммуноглобулинов, в результате которого каждый отдельный B–лимфоцит оказывается способен к синтезу единственного варианта АТ по признаку структуры антигенсвязывающего центра молекулы. В динамике по мере дифференцировки B–лимфоцита, уже распознавшего свой Аг и вступившего в межклеточные взаимодействия, необходимые для развития иммунного ответа, происходит переключение синтеза изотипа иммуноглобулина при сохранении неизменной структуры антигенсвязывающего центра.
Вся совокупность B–лимфоцитов организма, способны синтезировать разнообразие АТ — около 106–109.
Каждому единичному B–лимфоциту и его митотически возникшим дочерним клеткам (это клон лимфоцитов по определению) «на роду написано» обслужить, если потребуется, некоторое множество Аг. Никто не может в принципе посчитать точно, сколько разных Аг потенциально способен связать один иммуноглобулин.
4.3. Биохимические свойства иммуноглобулинов
Известно два типа лёгких цепей иммуноглобулинов — k (каппа) и l (ламбда). Соотношение количеств k и l — видоспецифичный и строго стабильный генетический признак: у человека оно равно 2:1, у мыши — 20:1, у кошки — 1:20. Отклонение от этого соотношения у отдельных особей имеет диагностическое значение, так как является скорее всего признаком опухолевого процесса — B–лейкоза. Функциональных различий между иммуноглобулинами с лёгкими k–цепями или с лёгкими l–цепями до сих пор никто не выявил.
Классы иммуноглобулинов различаются между собой по тяжёлым цепям. Тяжёлые цепи обозначают греческими буквами соответственно латинской аббревиатуре класса: для IgM — m, для IgG — g, для IgA — a, для IgE — e, для IgD — d (рис. 4.2).
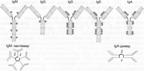
Рис. 4.2. Строение иммуноглобулинов пяти разных классов (схема). 1 — углеводные компоненты молекул иммуноглобулинов; 2 — J–цепь (от joint) — полипептидная цепь, связующая IgM в пентамер, a IgA в димер. IgA при секреции сквозь слизистые оболочки формирует димерный комплекс; IgM в крови формирует пентамерный комплекс.
Лёгкие цепи примыкают к N–концу тяжёлых цепей. C–конец тяжёлых цепей формирует Fc–фрагмент молекулы иммуноглобулина.
Вторично регулярная структура полипептидных цепей представлена доменами. Домен составляют 110 остатков АК. Каждая L–цепь состоит из двух доменов — VL и CL. H–цепи молекул IgG, IgD и IgA состоят каждая из 4 доменов VH и СH1, СH2, СH3. H–цепи молекул IgM и IgE имеют по «лишнему» 5-му домену. По первичной структуре C–домены похожи. Это указывает на то, что кодирующие их структурные гены когда-то произошли путём дупликаций из общего предкового гена. По данным электронной микроскопии и рентгеноструктурного анализа кристаллов иммуноглобулинов, цепи сплетены в «косичку». Угол между двумя симметричными антигенсвязывающими центрами молекулы подвижен в диапазоне от 0 до 100° и больше. Антигенсвязывающие участки молекулы способны к ротационному движению. Все это вместе облегчает возможность связывания Аг обоими активными центрами одновременно. Это существенно: опыт показывает, что в природе устроено так, что «достойный» иммунный ответ развивается лишь в тех случаях, когда (и если) Аг «сшивает» несколько антигенраспознающих Рц на поверхности лимфоцита.
IgM и IgA формируют полимерные структуры: IgM из 5 «рогаток» формирует пентамер, находящийся в растворе в крови; IgA из двух «рогаток» формирует димер, но не в крови, а в составе экзосекретов на слизистых оболочках. Для полимеризации IgM и IgA включают в свой состав дополнительную полипептидную цепочку с молекулярной массой 15 тыс., называемую J–цепью (joint — связь). Эта J–цепь связывает терминальные цистеины на C–концах соответственно тяжёлых m- и a–цепей IgM и IgA.
Секреция IgA через слизистые оболочки наружу происходит в процессе так называемого трансцитоза через клетки эпителия слизистых оболочек. Изотип IgA синтезируется главным образом B–лимфоцитами неинкапсулированной лимфоидной ткани слизистых оболочек ЖКТ, дыхательных путей, мочеполовых путей, слёзных, слюнных и молочных желёз. Димер IgA диффундирует сквозь базальную мембрану слизистых оболочек. На базолатеральной поверхности эпителиальных клеток слизистых оболочек экспрессированы особые Рц для молекул иммуноглобулинов, так называемые поли–Ig–Рц. Эти Рц сорбируют димеры IgA, после чего происходят эндоцитоз комплексов поли–Ig– Рц — димер IgA, трансцитоз внутри эпителиальной клетки в виде особой везикулы и экскреция этого комплекса наружу в состав слизи. При экскреции от поли–Ig–Рц отщепляется небольшой фрагмент. Бoльшая его часть остаётся в связи с димером IgA, её называют секреторным компонентом.
Папаин расщепляет молекулу иммуноглобулина выше дисульфидных связей между тяжёлыми цепями, поэтому в результате получаются два Fab–фрагмента и двухцепочный Fc–фрагмент. Пепсин расщепляет молекулу иммуноглобулина ниже дисульфидных связей между тяжёлыми цепями и в результате получается (Fàb)2–фрагмент (двухвалентный по связыванию Аг) и одноцепочные Fc–фрагменты.
Во всех доменах молекул иммуноглобулинов есть одинаковые (общие) последовательности остатков АК. С наибольшей стабильностью в этих консервативных (или, как их ещё называют, гомологичных) последовательностях присутствует триптофан. Наличие таких консервативных общих последовательностей рассматривают как молекулярное свидетельство генетической общности: гены, кодирующие отдельные домены, произошли из общего предкового гена (путём дупликации, мультипликации и затем дивергентной эволюции). Гомологичные названным последовательности АК присутствуют, помимо иммуноглобулинов, и в молекулах других белков. Эти другие белки экспрессируются в клетках иммунной и по крайней мере нервной систем. Такой общности в структуре соответствует и общность функционального предназначения — участие в процессах молекулярного распознавания и взаимодействия клеток. Белки, содержащие последовательности АК, идентифицированные исходно в иммуноглобулинах, объединяют в одно молекулярное надсемейство — надсемейство иммуноглобулинов IgSF (immunoglobuline superfamily). Кроме самих иммуноглобулинов, к этому надсемейству относят Рц T–лимфоцитов для Аг (TCR — T–cell receptor); не все, но ряд Рц клеток для цитокинов (для ИЛ–1 тип I и II, ИЛ–6, M–CSF, c–kit [CD117]), мембранные молекулы межклеточной адгезии (ICAM–2, ICAM–3, VCAM–1), Рц клеток для Fc–"xвocтов» иммуноглобулинов классов А и G (FcaR, FcgRI, FcgRII), мембранную молекулу CD80 — лиганд для CD28, мембранные молекулы CD4, CD8, CD3 и др.
Все эти молекулярно–генетические родственники фундаментально и дружно задействованы в иммунном ответе.
Вариабельные последовательности АК (т.е. разные у иммуноглобулинов, являющихся продуктами различных B–лимфоцитов) не случайно распределены по V–области, а чётко локализованы в определённых участках, называемых гипервариабельными областями — их выделяют от 3 до 4: HV1, HV2, HV3, HV4 (HV — от HyperVariable). У обозначений «НV» есть синоним — CDR: CDR1, CDR2, CDR3 и CDR4. Именно эти последовательности АК вступают в непосредственное комплементарное связывание с Аг. Связывание с Аг обусловлено следующими типами химических взаимодействий (сил, связей) между молекулой АТ (так же, как и Рц T–клеток для Аг) и молекулой Аг: ионными, ван–дер–ваальсовыми, водородными и гидрофобными. Оптимальная реализация этих связей возможна только при физиологических значениях pH, ионной силы, концентрации солей. Если в лабораторной работе in vitro стоит задача диссоциировать комплекс Аг–АТ, то подбирают необходимые и достаточные изменения pH, ионной силы или вводят в систему детергенты.
Иммуноглобулины могут связывать лиганды (Аг) разной химической природы: пептиды, углеводы, полифосфаты, стероиды. Существенным и уникальным свойством АТ, отличающим их даже от Рц T–клеток для Аг, является их способность вступать в связывание с цельными, нативными молекулами Аг, непосредственно в том виде, в каком Аг проник во внутреннюю среду организма. Для этого не требуется никакая предварительная метаболическая обработка Аг. Следовательно, не требуется и время на предобработку, и связывание Аг происходит немедленно.
АТ — единственный фактор безотлагательной защиты организма, например от сильных ядов (при укусах змей, скорпионов, пчёл и др.). Аг могут связывать лёгкие и тяжёлые цепи молекул иммуноглобулинов по отдельности, могут и вместе. У цельной молекулы мономерного иммуноглобулина два цельных и потенциально равнодееспособных симметрично расположенных активных центра для связывания Аг. Сродство между Аг и АТ количественно характеризуют такими понятиями, как аффинность и авидность.
Аффинность связи АТ с Аг — сила химической связи одного антигенного эпитопа с одним из активных центров молекулы иммуноглобулина.
Аффинность количественно принято оценивать по константе диссоциации одного антигенного эпитопа с одним активным центром в моль–1. Так как в цельных молекулах АТ классов IgG и IgE в норме по два активных центра, а в молекулах IgA — 4, IgM — 10, скорость диссоциации цельной молекулы иммуноглобулина от цельной молекулы Аг меньше, чем скорость диссоциации одного из активных центров.
Авидность связи АТ с Аг — сила связи цельной молекулы АТ со всеми антигенными эпитопами, которые ей удалось связать.
Авидность количественно также измеряют как константу диссоциации соответственно цельной молекулы АТ со всеми связанными эпитопами.
Эпитоп — это небольшой участок цельной молекулы Аг, который непосредственно вступает в ионные, водородные, ван–дер–ваальсовы и гидрофобные связи с активным центром АТ.
Если Аг — пептид, то размер эпитопа составляет от 5 до 7 АК–остатков. Площадь связи активного центра с эпитопом равна 70–90 нм2. Синоним антигенного эпитопа — антигенная детерминанта. Эпитоп может представлять собой участок последовательно связанных АК–остатков. Такой эпитоп называют линейным (continuous). Но эпитоп может быть сформирован во вторичной структуре макромолекулы Аг не из последовательно связанных АК. Такие эпитопы называют конформационными (discontinuous epitopes). Современные химики успешно имитируют линейные эпитопы белковых Аг, синтезируя пептиды любой заданной длины. Воссоздание конформационных эпитопов в синтетических пептидах — гораздо более трудная задача.
Промежутки между CDR обозначают как FR (Framework Regions), т.е. каркасные области. Их также 4: FR1, FR2, FR3 и FR4. Последовательности АК–остатков в них весьма консервативны. Исследования самых последних лет показывают, что этим консервативным последовательностям, кроме чисто «скелетной» функции, случаетсявыполнять и другие функции, отличные и от связывания с Аг. Связывание с Аг — функция CDR. Забегая вперед, скажем, что в FR–участках V–области молекул иммуноглобулинов могут локализоваться такие активности, как ферментативная (протеазная и нуклеазная), связывание ионов металлов, связывание с суперантигенами.
4.4. Гены иммуноглобулинов
Индивидуальный организм здорового человека в течение жизни в B–лимфоцитах создаёт несколько миллионов вариантов АТ по способности связывать разные Аг (потенциально 1016 Аг). Никакой геном физически не несет столько отдельных структурных генов. Всего в геноме человека более 23 тыс. генов. Наследуемое от родителей количество генетического материала (ДНК), предназначенного для программирования биосинтеза АТ, не так уж и велико — всего 120 структурных генов. Это наследуемое множество генов называют зародышевыми генамииммуноглобулинов, или зародышевой конфигурацией генов.
Разнообразие генетических кодов для миллионов вариантов вариабельных участков молекул иммуноглобулинов формируется в течение всей жизни в процессе дифференцировки B–лимфоцитов: в каждом отдельном B–лимфоците происходит неповторимая рекомбинация ДНК из сегментов зародышевых генов, и трансляция РНК, и последующий синтез белка уже идут с уникального для каждого B–лимфоцита генетического кода V–области.
Феномен рекомбинации ДНК в соматических клетках, по крайней мере насколько известно современной науке, строго уникален исключительно для лимфоцитов. Подобного никто не наблюдал не только при дифференцировке каких–либо других клеток млекопитающих, но даже и каких–либо клеток иных эукариот. Соматическая рекомбинация ДНК «ниспослана» только генам антигенраспознающих молекул лимфоцитов — иммуноглобулинов в B–лимфоцитах и Рц T–клеток для Аг в T–лимфоцитах.
Этот уникальный процесс генерации разнообразия антигенраспознающих молекул внутри организма понадобился для того, чтобы многоклеточные видов с малым числом потомков сумели выжить под инфекционным давлением разнообразных земных микроорганизмов. Млекопитающие эволюционируют так медленно, что человеку трудно это даже представить. Микроорганизмы, наоборот, эволюционируют в считанные дни — недели. Так вот, лимфоциты — специальное уникальное творение природы внутри организма многоклеточных с неслучайной, но запрограммированной изменчивостью только в генах антигенсвязывающих молекул (иммуноглобулины, TCR) в количественном отношении хоть в какой-то мере сопоставимой с разнообразием микробов. Разнообразие это столь велико (например, относительно общего числа клеток в организме млекопитающего), что механизм генерации разнообразия соответствующих структурных генов мог быть (и стал) в основе запрограммированно случайным. Свойство случайности при рекомбинации соответствующей ДНК объясняет тот широко известный факт, что иммунная система «в лице» лимфоцитов распознаёт разные вещества, а не только инфекционные микроорганизмы. В естественных природных условиях инфекционные микроорганизмы в большей мере, чем другие внешние объекты, способны прорываться сквозь барьерные ткани многоклеточных. Если покровные ткани «подтекают», т.е. в силу каких–либо патологических причин, например, барьеры ЖКТ или слизистые оболочки дыхательной системы пропускают лишнее из пищи или вдыхаемых веществ, то лимфоциты распознают и реагируют на пищевые и ингаляционные Аг. Но вот к чему природа не готовила иммунную систему, так это к быстрому внедрению непосредственно во внутреннюю среду, минуя барьерные ткани, чужеродных веществ. Это чисто антропогенные деяния по парентеральным введениям, вливаниям чужой крови, трансплантациям органов. Например, трансплантат чужого органа организм реципиента отторгает, как это не покажется странным, по ошибке, которую совершают примерно 1–10% T–лимфоцитов, они принимают Аг главного комплекса гистосовместимости на чужих клетках трансплантата за свои. Если бы все 100%, а не 90% T–лимфоцитов никогда не ошибались, то чужая почка, печень, кожа, кровь и т.п. оставались бы «невидимыми» для иммунной системы.
Примерно 30 лет назад ещё методами классической биохимии, а именно аналитическим электрофорезом фрагментированной ДНК, обнаружили, что генетический материал для кодирования белков-иммуноглобулинов структурирован («разорван») на сегменты, расположенные друг относительно друга на уловимом расстоянии. Во всех клетках тела, включая стволовую кроветворную, кроме начавших дифференцировку B–лимфоцитов, гены иммуноглобулинов навсегда остаются в «разорванном» состоянии, которое называют зародышевой конфигурацией. И только в B–лимфоцитах на самом раннем этапе их специальной дифференцировки начинается сложный генетический процесс объединения сегментов ДНК, предназначенных для кодирования разных частей молекулы иммуноглобулина — V– и C–фрагментов, причём по отдельности для каждой из 3 типов полипептидных цепей — 2 типов лёгких (k и l) и тяжёлой. Это и есть феномен рекомбинации ДНК в соматической клетке. Этот феномен открыли С. Тонегава и его коллеги (1975–1976) при электрофорезе ДНК, выявившем разницу во фрагментах рестрикции ДНК из антителопродуцирующих B–лимфоцитов и из любых других не продуцирующих АТ клеток данного организма (зародышевая конфигурация).
Структура генов иммуноглобулинов подробно изучена (рис. 4.3 и 4.4). Отдельные сегменты молекулярно клонированы, определено их число. Кодирующая ДНК для вариабельной части каждой из цепей иммуноглобулина собирается из сегментов, извлекаемых из трёх отдельных кластеров: собственно V (вариабельный) (код для 95–101 АК), а также D (от Diversity — разнообразие) у тяжёлых цепей и J (от Joining — связующий) (код для нескольких АК — до 13).
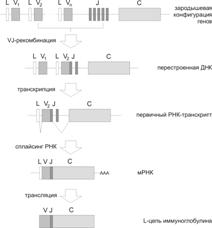
Рис. 4.3. Структура генов лёгкой цепи (L) иммуноглобулинов.
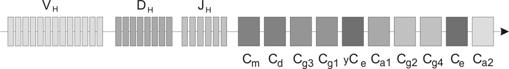
Рис. 4.4. Структура генов тяжёлой (Н) цепи иммуноглобулинов.
Переключение синтеза изотипов иммуноглобулинов показано на рис. 4.5. Гены для k–цепи локализованы в хромосоме 2, гены для l–цепи — в хромосоме 22, гены для тяжёлых цепей всех изотипов — в хромосоме 14 (табл. 4.1).
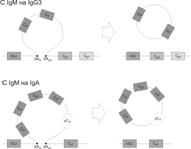
Рис. 4.5. Рекомбинация ДНК при переключении изотипов иммуноглобулинов B–лимфоцитов.
Молекулярные генетики группируют сегменты V–генов в несколько семейств. В одно семейство включают гены, в которых более 80% последовательности нуклеотидов гомологичны. Выделяют 7 семейств Vh, 7 семейств Vk, 8 семейств Vl. Считают, что члены одного семейства произошли от одного древнего гена путём дупликаций.
Таблица 4.1. Число сегментов генов вариабельных областей иммуноглобулинов человека*
| Кластер сегментов | Лёгкие цепи | Тяжёлая цепь | |
| | | ||
| V | |||
| D | Нет | Нет | |
| J |
* Поскольку метод молекулярного клонирования трудоемок и его выполняют всякий раз для конкретного индивидуального генома, разумно допустить, что у отдельных индивидуумов конкретное число сегментов может варьировать, но в узких пределах; также разным может быть число псевдогенов.
Рекомбинацию ДНК иммуноглобулинов катализируют специальные ферменты — рекомбиназы. Эти же ферменты катализируют рекомбинацию ДНК генов TCR в T–лимфоцитах, т.е. рекомбиназы — уникальные ферменты лимфоцитов. Но в B–лимфоцитах эти ферменты не «трогают» гены TCR, а в T–лимфоцитах не «трогают» гены иммуноглобулинов. Следовательно, до начала процесса перестройки ДНК в клетке уже существуют генрегуляторные протеины — свои у T–лимфоцитов и свои у B–лимфоцитов. Гены, кодирующие эти белки, называют мастер–генами. Они в большей степени воображаемые, чем изученные, но являются реальным объектом исследования фундаментальной науки. Субстратом для рекомбиназ служат определённые последовательности нуклеотидов в ДНК генов–мишеней (кстати, одинаковые у T– и B–лимфоцитов). Эти последовательности фланкируют (т.е. расположены с какого–либо края) каждый отдельный сегмент генов–мишеней и их называют сигнальными для рекомбинации (rss — Recombination Signal Sequencs). Rss расположены с 3'–конца V–сегментов, с 5'–конца J–сегментов и с обеих сторон D–сегментов. Последовательность нуклеотидов в rss расшифрована: консервативный гептамер CACAGTG, затем вариабельный спейсер из 12 или 23 нуклеотидов и консервативный нонамер ACAAAAACC/GGТТТТТGT. Самый первый акт расщепления цепи ДНК осуществляют два других специальных фермента лимфоцитов — гетеродимерные эндонуклеазы, кодируемые генами, называемыми RAG1и RAG2. Последовательность нуклеотидов в гене RAG1 подобна таковой в гене дрожжей HRP–1 и в генах топоизомераз бактерий, катализирующих разрывы и сшивки ДНК, что свидетельствует о «глубинном» единстве всего живого. Но среди клеток млекопитающих RAG1 и RAG2 экспрессируются только в лимфоцитах. Репарацию разрывов ДНК катализируют по крайней мере 3 ядерных фермента: один называют аутоантигеном Ku, второй — ДНК–зависимой протеинкиназой, третий ещё недостаточно охарактеризован.
Дата добавления: 2016-07-18; просмотров: 2572;











