СТРУКТУРА И ФУНКЦИИ ИММУННОЙ СИСТЕМЫ 5 глава
Кроветворение — дифференцировка клеток крови, или гемопоэз, в раннем эмбриогенезе млекопитающих начинается в кровяных островках мезодермы, затем «перемещается» в печень, селёзенку и костный мозг эмбриона. После рождения гемопоэз поддерживается в течение всей жизни в костном мозге плоских костей — грудине, ребрах, крыльях подвздошной кости, костях черепа и в позвонках. Все клетки крови происходят из общей клетки–предшественницы — стволовой кроветворной клетки (СКК). Относительно параметров состояния пула СКК есть две гипотезы. Строгие доказательства правильности какой–либо одной из них отсутствуют, и получить их, очевидно, не просто. Одна из гипотез подразумевает, что популяция стволовых клеток делится в течение всей жизни. Вторая гипотеза предполагает, что у взрослых организмов пул истинно стволовых клеток не пополняется за счёт их пролиферации, а только расходуется в течение всей жизни на гемопоэз. Пролиферируют уже коммитированные потомки СКК на определённых этапах своей дифференцировки. Если принять вторую гипотезу, то можно сделать один рабочий вывод: следует быть осторожным с терапевтическими вмешательствами, способными несоразмерно стимулировать гемопоэз или отдельные его ростки (они, кстати, регулируются независимо друг от друга, кроме точек ветвления на альтернативную дифференцировку, например, нейтрофилы и моноциты, эозинофилы и базофилы), чтобы не израсходовать досрочно «золотой запас» СКК.
На территории костного мозга проходит полный «курс» эритропоэза (заканчивается эритроцитами), миелопоэза (заканчивается нейтрофилами, моноцитами, эозинофилами, базофилами), мегакариоцитопоэза (заканчивается тромбоцитами), дифференцировки дендритных клеток и, вероятно, NK, а также лимфопоэза В2–лимфоцитов («классических», в смысле «давно известных»). Для дефинитивных потомков В2–лимфоцитов — плазматических клеток костный мозг является и «периферическим» лимфоидным органом. Значительная часть В2–лимфоцитов, пройдя «курс» иммуногенеза в периферических лимфоидных органах (лимфатических узлах, селёзенке) и превратившись в плазмоциты, возвращается на территорию костного мозга, и там плазмоцит вырабатывает свой ресурс по продукции больших количеств АТ в течение периода от нескольких дней до месяца.
Клетки–предшественницы второй субпопуляции B–лимфоцитов — В1 ещё в периоде эмбриогенеза отселяются из костного мозга в брюшную и плевральную полости и там поддерживают дифференцировку этих «полостных» В1–лимфоцитов в течение всей жизни уже автономно от СКК костного мозга. Если по какой-то причине предшественники В1–лимфоцитов повреждаются, то регенерация популяции В1–лимфоцитов не поддерживается за счёт СКК костного мозга.
Другие ветви дифференцировки общей лимфоидной клетки–предшественницы, а именно предшественники T–лимфоцитов, для прохождения своего лимфопоэза выселяются из костного мозга в другие органы и ткани (тимус и слизистую оболочку ЖКТ).
2.2. Тимус
Тимус (thymus) — специализированный лимфоидный орган, в котором проходит лимфопоэз бoльшая часть T–лимфоцитов организма (аббревиатура «Т» происходит от «Thymus»). Тимус расположен в переднем верхнем средостении, за грудиной, над сердцем. Тимус состоит из двух больших долей, которые фрагментированы на множество долек, разделённых фиброзными перегородками. Эти дольки и являются структурными единицами строения тимуса (рис. 2.2). В каждой дольке чётко различимы две гистологические зоны: по периферии — корковая, в центре — мозговая. Строма тимуса эпителиальная. Полагают, что эпителий разных его зон происходит из различных зародышевых листков. Эпителий корковой зоны эктодермального происхождения, в эмбриогенезе развивается из 3–го и 4–го глоточных выпячиваний эктодермы. Эпителий мозговой зоны энтодермального происхождения и закладывается из 3–го и 4–го глоточных карманов.
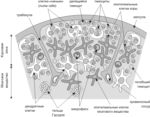
Рис. 2.2. Строение дольки тимуса. 1 — корковая зона; 2 — мозговое вещество; 3 — эпителиальные клетки коры (nurse cells) (эктодермального происхождения); 4 — эпителиальные клетки мозгового вещества (энтодермального происхождения); 5 — дендритные клетки (костномозгового происхождения); 6 — макрофаги (костномозгового происхождения); 7 — тимоциты — лимфоциты тимуса (костномозгового происхождения).
Есть в тимусе и такие необычные клетки, как миоидные. Они происходят, вероятно, из нервного гребня. В норме их немного. Эти клетки содержат белки, характерные для мышечных клеток (актин, миозин и др.). У мышей морфогенез тимуса различимо проходит с 9-х по 11-е сутки эмбрионального развития.
Эпителиальные клетки тимуса имеют особую морфологию. Эпителиальные клетки коры своими отростками «обнимают и баюкают» лимфоциты тимуса (тимоциты), поэтому они названы nurse cells (клетки–"сиделки», «медсёстры», «нянечки»).
Эпителиальные клетки тимуса продуцируют цитокины ИЛ–1, ИЛ–3, ИЛ–6, ИЛ–7, LIF, GM–CSF. На клетках эпителия тимуса экспрессированы такие молекулы адгезии, как LFA–3 и ICAM–1, которые комплементарны молекулам адгезии на тимоцитах — соответственно CD2 и LFA–1. Эти взаимодействия и удерживают развивающиеся тимоциты на территории тимуса на необходимое для дифференцировки время.
Клетки мезенхимного, или костномозгового происхождения в тимусе представлены тимоцитами (это лимфоциты тимуса), а также дендритными клетками тимуса и макрофагами. Дендритные клетки расположены преимущественно в зоне, переходной между корковой и мозговой. Макрофаги присутствуют в корковой зоне, пограничной и мозговой.
Тимоциты дифференцируются из общей стволовой кроветворной клетки. На клетках–предшественницах тимоцитов ещё вне тимуса у человека экспрессированы известные молекулы клеточных мембран CD7, CD2, CD34 и цитоплазматическая форма CD3. У мыши на претимоцитах обнаружены маркёры Thy–1, HSA, Pgp–1, H–2, Sca–1 (Ly–6 A/E), немного CD4. Клетки–предшественницы приходят в тимус через стенку венул с высоким эндотелием в корково–мозговой области и оттуда мигрируют в субкапсулярную зону.
У молодой мыши в возрасте 5–8 нед в тимусе содержится »2´108 тимоцитов. При этом ежедневно в результате митозов вновь образуется 5´107 тимоцитов. Но в периферические лимфоидные органы выходит около 106 зрелых неиммунных T–лимфоцитов, т.е. меньше 1% от общего числа тимоцитов. Остальные 99% тимоцитов погибают в тимусе по механизму апоптоза и устраняются фагоцитозом макрофагами. Правда, гистологических признаков столь массовой гибели клеток именно на территории тимуса нет. Поэтому более вероятно, что запрограммированные на гибель тимоциты ещё живыми уходят из тимуса и попадают напрямую в органы, специализированные на катаболизме и выведении из организма, — в печень, селёзенку, кишечник. Там эти клетки и разрушаются. Таковы вкратце закономерности дифференцировки T–лимфоцитов.
В мозговой зоне долек имеются плотные образования из скрученных эпителиальных клеток — тельца Гассаля (тельца вилочковой железы). Вероятно, это места компактного скопления дегенерирующих эпителиальных клеток.
Тимус интенсивно васкуляризирован. Стенки капилляров и венул — это гематотимический барьер на входе в тимус и, возможно, на выходе из него. Выход зрелых лимфоцитов из тимуса либо свободен (каждая долька имеет эфферентный лимфатический сосуд, выносящий лимфу в лимфатические узлы средостения, оттуда в грудной лимфатический проток и через него в системную циркуляцию), либо происходит путём экстравазации через стенку посткапиллярных венул с высоким эндотелием в корково–мозговой области и/или через стенку капилляров.
От других лимфоидных органов тимус отличает особая постнатальная динамика его морфогенеза в зависимости от возраста. К моменту рождения тимус полностью сформирован. Он густо заселен лимфоцитами (тимоцитами) в течение всего детства и до момента полового созревания. После пубертатного периода тимус начинает уменьшаться в размерах, сморщиваться. Удивительно, но тимэктомия у взрослых не приводит к серьёзным дефектам в иммунитете, как если бы в детстве и подростковом возрасте был создан необходимый и достаточный пул периферических T–лимфоцитов на всю оставшуюся жизнь. Казалось бы, анатомия тимуса и его возрастная инволюция давно известны, но где хранится, как расходуется и как регенерирует множество T–лимфоцитов на протяжении жизни человека — это некоторая почти разгаданная загадка.
2.3. Лимфатические узлы
Лимфатические узлы — множественные, симметрично расположенные, инкапсулированные периферические лимфоидные органы бобовидной формы, размером от 0,5 до 1,5 см в длину (вне воспаления). Лимфатические узлы через афферентные лимфатические сосуды (которых несколько на один узел) дренируют тканевую жидкость. Лимфатические узлы расположены регионарно и называются в соответствии с частью тела, которую они «обслуживают»: околоушные, заднешейные, подмышечные, подколенные, паховые, брыжеечные и т.д. Таким образом, лимфатические узлы — это «таможня» для всех веществ (в том числе Аг), попадающих во внутреннюю среду организма.
Афферентные лимфатические сосуды впадают в субкапсулярный синус лимфатического узла. Из анатомических ворот узла параллельно с артерией и веной выходит единственный эфферентный сосуд, несущий лимфу в конечном итоге в грудной лимфатический проток, который впадает в нижнюю полую вену и таким образом лимфа вливается в системный кровоток.
Строение лимфатического узла показано на рис. 2.3.
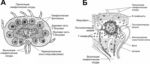
Рис. 2.3. Строение лимфатического узла. 1 — афферентные лимфатические сосуды; 2 — эфферентный лимфатический сосуд; 3 — артерия; 4 — вена; 5 — посткапиллярная венула в паракортикальной зоне; B–клеточная зона (6 — первичный фолликул; 7 — центр размножения; 8 — вторичный фолликул); 9 — паракортикальная зона — T–клеточная зона (здесь локализованы посткапиллярные венулы с высоким эндотелием); 10 — мозговое вещество.
Лимфатический узел состоит из коркового и мозгового вещества.
B–клеточная зона. Корковое вещество лимфатического узларазделено соединительнотканными перегородками на радиальные секторы и содержит лимфоидные фолликулы, B–лимфоцитарная зона. Строма фолликулов содержит фолликулярные дендритные клетки (ФДК), формирующие то особое микроокружение, в котором происходит уникальный для B–лимфоцитов процесс соматического гипермутагенеза вариабельных сегментов генов иммуноглобулинов и отбор наиболее аффинных вариантов АТ («созревание аффинности АТ»). Лимфоидные фолликулы проходят 3 стадии развития. Первичный фолликул — мелкий фолликул, состоящий из неиммунных B–лимфоцитов. После того как B–лимфоцит распознаёт Аг и получит все необходимые костимулирующие сигналы, он вступит в иммуногенез, строго необходимым этапом которого является пролиферация клона B–лимфоцитов. Фолликул, содержащий интенсивно пролиферирующие B–лимфоциты, называют герминативным центром (центр размножения). Первичный фолликул преобразуется в активный, т.е. содержащий центр размножения в течение примерно 1 нед после активной иммунизации. По завершении процесса иммуногенеза лимфоидный фолликул существенно уменьшается в размере, это вторичный фолликул.
T–клеточная зона. В паракортикалъной зоне лимфатического узла расположены T–лимфоциты и посткапиллярные венулы, через стенку которых происходит миграция лимфоцитов из крови в лимфатический узел. Это T–зависимая зона. В активном состоянии посткапиллярные венулы имеют не плоский, а высокий эндотелий. В T–зависимой зоне содержится много интердигитирующих дендритных клеток. Это совсем другие дендритные клетки, чем фолликулярные дендритные клетки.
Интердигиталъные дендритные клетки — клетки костномозгового происхождения, мигрировавшие в узел с тканевой жидкостью по афферентным лимфатическим сосудам из покровных тканей (в коже эти клетки называют клетками Лангерганса, или белыми отростчатыми эпидермоцитами), это АПК для T–лимфоцитов.
Под паракортикальной зоной расположены мозговые тяжи, в которых много макрофагов, и, если узел находится в состоянии активного иммунного ответа, в этих тяжах можно видеть зрелые B–лимфоциты (плазматические клетки). Тяжи впадают в синус мозгового вещества, из которого выходит эфферентный лимфатический сосуд.
2.4. Селезёнка
Селезёнка — относительно большой непарный орган, с массой в среднем 150 г у взрослого человека. Лимфоидную ткань селезёнки называют белой пульпой. Селезёнка — лимфоцитарная «таможня» для Аг, попавших в системную циркуляцию. Лимфоциты селезёнки локализованы вокруг артериол в виде так называемых периартериолярных муфт. Поперечный и продольный срезы периартериолярной муфты показаны на рис. 2.4.
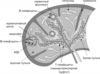
Рис. 2.4. Строение периартериолярной лимфоидной муфты в селёзенке. 1 — краевая зона белой пульпы; 2 — B–клеточная «корона» в краевой зоне; 3 — фолликул; 4 — T–клеточная «муфта"; 5 — артериола; 6 — краевой синус.
T–зависимая зона муфты непосредственно окружает артериолу. B–клеточные фолликулы расположены ближе к краю муфты. Артериолы селезёнки впадают в синусоиды (это уже красная пульпа). Синусоиды заканчиваются венулами, которые собираются в селезёночную вену, несущую кровь в воротную вену печени.
2.5. Печень
О том, что печень имеет уникальные функции в иммунной системе организма, свидетельствуют следующие факты.
Ú В эмбриональном периоде развития печень является мощным органом кроветворения и лимфопоэза; есть или нет хоть в какой-то мере лимфопоэз в печени у взрослых — вопрос открытый, и возможно что есть.
Ú Аллогенные трансплантаты печени не отторгаются или почти не отторгаются (по крайней мере не требуют столь жёсткой иммуносупрессивной химиотерапии, как трансплантаты других органов).
Ú Толерантность на вводимые перорально Аг можно индуцировать только при нормальном физиологическом кровоснабжении печени и не удаётся индуцировать после хирургической операции по созданию портокавальных анастомозов.
Ú Печень синтезирует белки острой фазы — C–реактивный белок и связывающий маннозу лектин, которые являются растворимыми Рц, непосредственно связывающими микробные продукты.
Ú Печень синтезирует белки системы комплемента, в том числе C1. C1q тоже непосредственно связывает бактериальные продукты и инициирует активацию всей системы комплемента. Без активации системы комплемента невозможен адекватный гуморальный иммунный ответ в виде синтеза АТ в B–лимфоцитах.
Ú В печени содержатся собственные субпопуляции лимфоцитов, в том числе уникальные лимфоциты, сочетающие в себе признаки T– и NK–лимфоцитов.
Клеточный составпечени известен из гистологии.
1. Паренхима печени — гепатоциты — крупные полиморфные клетки (30 мкм в диаметре), у взрослых 25% гепатоцитов тетраплоидны. На гепатоцитах содержится очень мало молекул MHC класса I и в здоровой печени нет молекул MHC II, которые, однако, могут экспрессироваться при заболеваниях этого органа.
2. Купферовские клетки — макрофаги печени. Они составляют около 15% от общего числа клеток печени и 80% всех макрофагов тела (по приблизительной оценке). Плотность макрофагов выше в перипортальных областях печени, чем в среднем по органу.
3. Эндотелиальные клетки синусоидов печени особенные — под ними нет базальной мембраны.
4. Звездчатые клетки, или клетки Ито, — уникальные клетки в пространствах Диссе (перисинусоидальные пространства). Эти клетки ещё называют липоцитами, так как они содержат жировые вакуоли с витамином А. Но они содержат также контрактильные белки — a-актин и десмин, характерные для гладкомышечных клеток, — и могут трансформироваться в миофибробласты. Клетки Ito также являются основными синтезаторами коллагена в печени.
5. Лимфоидная система печени, помимо лимфоцитов, содержит ещё и анатомический субстрат циркуляции лимфы — это пространства Диссе. Эти пространства непосредственно открыты для содержимого портального тракта с одной стороны и также без всяких барьеров для ткани печени с другой стороны. Лимфоток в печени составляет, по-видимому, не менее 15–20% всего лимфотока в организме (т.е. больше, чем в любом другом органе тела).
Достоверно подсчитать количество лимфоцитов в печени — за пределами возможностей существующих методов, так как при выделении лимфоцитов в суспензию потери велики и не контролируемы. Работ по подсчёту субпопуляций лимфоцитов в печени крайне мало. Соответственно результаты практически не проверяемы. Но те, что есть, показывают следующее распределение (по данным проточной цитофлюорометрии):
а) на 1 г ткани печени приходится 2–15´106 лимфоцитов;
б) внутрипечёночные лимфоциты составляют примерно 25% непаренхиматозных клеток печени (купфферовские клетки тоже 25%);
в) лимфоциты NK составляют 20% всех лимфоцитов;
г) лимфоциты Tab составляют 20% всех лимфоцитов, из них CD8+ в 5–2 раза больше, чем CD4+ (соотношение CD8:CD4 = 4:1, по данным другой работы — 2:1), в любом случае в периферической крови наоборот — CD4:CD8=2:1.
д) лимфоциты Tgd составляют около 3% всех лимфоцитов;
е) B–лимфоцитов не более 5%, на большинстве из них экспрессированы IgA.
Есть обоснованное предположение, что лимфоциты печени обеспечивают постоянное поддержание иммунологической толерантности к пищевым веществам. Хотя, конечно, в какой-то мере иммунный ответ на пероральные вещества может развиваться, но он более выражен при патологии ЖКТ, или/и при аллергических заболеваниях, нежели в норме.
2.6. Лимфоидная ткань слизистых оболочек и кожи
Неинкапсулированная лимфоидная ткань слизистых оболочек — представлена глоточным лимфоидным кольцом Пирогова, пейеровыми бляшками тонкой кишки, лимфоидными фолликулами аппендикса, а также лимфоидной тканью слизистых оболочек желудка и кишечника, бронхов и бронхиол, слизистых оболочек мочеполовой системы и всех остальных слизистых оболочек.
Для примера рассмотрим строение пейеровой бляшки (рис. 2.5).
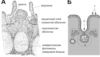
Рис. 2.5. Строение пейеровой бляшки в стенке кишки. А. Общий вид. Б. Сильно упрощенная схема. 1 — энтероциты (эпителий кишки); 2 — М–клетки; 3 — T–клеточная зона; 4 — B–клеточная зона; 5 — фолликул; 6 — серозная оболочка кишки. Масштаб между структурами не выдержан.
Пейеровы бляшки (по новой номенклатуре — групповые лимфатические фолликулы) располагаются в l. propria тонкой кишки. Каждая бляшка примыкает к эпителию кишки под так называемыми М–клетками («М» от membranous, эти клетки в отличие от энтероцитов не имеют ворсинок), являющимися «входными воротами» в пейерову бляшку. Основная масса лимфоцитов бляшки — это B–клеточный фолликул с зародышевым центром посередине. T–клеточные зоны окружают фолликул ближе к слою энтероцитов. B–лимфоциты составляют 50–70%, T–лимфоциты — 10–30% всех клеток пейеровой бляшки. Основная функциональная нагрузка пейеровых бляшек — поддержание иммуногенеза B–лимфоцитов и их дифференцировка в плазмоциты, продуцирующие АТ — иммуноглобулины секреторных классов А и Е (IgA и IgE). Продукция IgA в слизистой оболочке кишки составляет более 70% общей ежедневной продукции иммуноглобулинов в организме: у взрослого человека около 3 г IgA каждый день. Более 90% всего синтезируемого организмом IgE, оказывается, тоже экскретируется через слизистую оболочку кишки.
Организованная лимфоидная ткань слизистых оболочек, пусть даже и без капсул, это не единственное место пребывания лимфоцитов в слизистых оболочках. Есть ещё (и немало) лимфоциты, диссеминированные по одному среди эпителиальных клеток. Их назвали внутриэпителиальными лимфоцитами. Это T–лимфоциты. На их поверхности экспрессирована особая молекула, обеспечивающая адгезию этих лимфоцитов к энтероцитам — HML–1. У мышей большинство, а у человека не менее 10–50% внутриэпителиальных лимфоцитов составляют Tgd/CD8aa+.
В l. propria присутствует много диссеминированных активированных (иммунных) CD4+ T–лимфоцитов, мигрировавших сюда из мезентериальных лимфатических узлов для осуществления эффекторных реакций. Здесь много и иммунных B–лимфоцитов, и плазматических клеток, мигрировавших сюда из пейеровых бляшек и мезентериальных лимфатических узлов для осуществления массовой продукции секреторных иммуноглобулинов.
Таким образом, вполне оправдано понятие тканевой, местной иммунной подсистемы слизистых оболочек, так же, как и печени, и кожи. В каждой ткани популяции лимфоцитов имеют свои особенности. Более того, чтобы лимфоциту мигрировать в определённую ткань, ему необходимо экспрессировать на мембране определённый так называемый хоминг–Рц (от англ. home — дом, место «прописки» лимфоцита). Для внутриэпителиальных лимфоцитов слизистой оболочки кишки это HML–1, для внутриэпителиальных лимфоцитов кожи это CLA–1. Чтобы зрелому неиммунному T–лимфоциту, вышедшему из тимуса, попасть на территорию T–зависимой зоны лимфатического узла, ему необходимо экспрессировать на своей поверхности особую молекулу — L–селектин. Это важно понимать и в теоретическом аспекте, и в прикладном. В рутинных клинико–иммунологических анализах в качестве биологического материала используют периферическую кровь из вены. Так вот, если патологический процесс затронул тканевые лимфоциты и их клетки-партнёры (эндотелий, макрофаги, другие лейкоциты), то лимфоциты, циркулирующие в крови, лишь в минимальной мере могут нести на себе (или не нести совсем) признаки тканевой патологии, и неадекватность такого анализа на практике часто дискредитирует в целом то, что называют анализом иммунного статуса.
Миграция лимфоцитовмежду лимфоидными органами и не–лимфоидными тканями, несмотря на свою высокую интенсивность, ни в коем случае не напоминает «броуновское движение» — она строго и тонко регулируется экспрессией определённых молекул адгезии и их лигандов. В результате в каждой ткани, в каждом органе имеется свой особый субпопуляционный состав лимфоцитов и их клеток — партнёров по иммунному ответу.
· Глава 3
ДОИММУННЫЕ БИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ РЕЗИСТЕНТНОСТИ К ИНФЕКЦИЯМ
Любой живой организм превращает компоненты внешней среды в «себя», в «свою индивидуальную материю» путём биохимического «пищеварения». Своими литическими ферментами (протеазами, гидролазами), а также биохимическими окислителями (перекисными и оксидазотными радикалами) особь расщепляет чужое органическое вещество до мелких метаболитов и использует их в реакциях синтеза своего органического вещества, а лишнее выводит назад во внешнюю среду. Так же протеазы, гидролазы и окислительные радикалы расщепляют и проникающие в организм инфекционные микроорганизмы. Только для трофических функций существует система пищеварения, а для расщепления и окисления инфекционных микроорганизмов у многоклеточных предназначены особые дифференцированные клетки — это фагоциты (макрофаги и нейтрофилы) и определённые растворимые белки сыворотки крови и тканевой жидкости или секретов — система комплемента, лизоцим и др.
3.1. Рецепторы распознавания «чужого»
Каким образом организм отличает «чужое», которое надо переварить (расщепить), от своего органического вещества, которое, напротив, нельзя расщеплять, по крайней мере, в норме? Какие клетки и молекулы первыми распознают, что инфекция проникла во внутреннюю среду данного организма?
Иммунология второй половины XX в., открывшая строение и беспрецедентное молекулярное разнообразие Рц лимфоцитов для Аг, «по умолчанию» исходила из представления, что лимфоциты и есть те уникальные клетки, которые распознают чужое своими Рц для Аг. Но иммунология начала XXI в. уже располагает такими новыми данными, которые позволяют осмыслить (в том числе и «старые» наблюдения) в аспектах новой теоретической концепции. Новая концепция рассматривает защиту от инфекций более системно (в пределах индивидуального организма) и более эволюционно (в плане родства всех форм жизни на Земле). В самом конце XX в. были получены некие новые данные. Эти результаты получены в работах по «ковровым» исследованиям геномов (в том числе генома человека), в моделях на мышах с нокаутом заданных генов в комбинации с трансфекцией тоже заданных генов с индуцибельной экспрессией и работах с использованием множества других новых методов. Новые данные, однако, побуждают современных исследователей все чаще вспоминать и цитировать работы И. И. Мечникова, посвященные функциям фагоцитирующих клеток.
Давно известно, что лимфоцитарный иммунный ответ начинает бороться с инфекцией не раньше чем через 7–8 дней от момента проникновения микроба в организм. Но в течение этого начального времени микробы вовсе не размножаются беспрепятственно на территории организма. Им противостоят перечисленные нами ранее биологические механизмы доиммунной защиты от инфекций (покровные ткани, сосудистые реакции, бактерицидные и бактериосвязывающие гуморальные компоненты секретов и сыворотки, фагоциты). Следовательно, клетки-носители доиммунной защиты от инфекций и их растворимые продукты распознают факт проникновения патогена в организм первыми, задолго (дни) «до» лимфоцитов. Микробов во внешней среде бессчётное количество. Инфекционных заболеваний у млекопитающих мало по сравнению с многочисленностью окружающих микробов. Очевидно, что бoльшую часть микробов инактивируют именно доиммунные механизмы резистентности к инфекциям, не доводя процесс до развития иммунного воспаления с участием лимфоцитов. И лишь те инфекции и те дозы инфектов, с которыми не справляются доиммунные механизмы резистентности, «достаются» лимфоцитам. Причём клетки доиммунной резистентности — дендритные клетки и макрофаги — подают Аг лимфоцитам в прямом смысле «в и на» своём клеточном «теле» и секретируют ряд биологически активных веществ — цитокинов доиммунного воспаления. Среди последних крайне важны хемокины, которые сигнализируют лимфоцитам, что пора начинать иммунный ответ и какой именно характер он должен иметь. Лимфоциты не самодостаточны для начала иммунного ответа. Можно утверждать, что без процессов доиммунного воспаления правильного (а может быть, и никакого) лимфоцитарного иммунного ответа in vivo не бывает.
Относительно новой информацией являются экспериментальные факты, полученные при исследовании репертуара Рц лимфоцитов (Т и В), нормально выживающих и функционирующих в периферических тканях организма в состоянии гомеостаза лимфоидной ткани. Эти данные получены на моделях «нокауттрансгенных» мышей, без которых они были бы непостижимы. Так вот, данные показывают, что в тканях организма выживают те и только те лимфоциты, Рц (для Аг) которых распознают те или иные молекулярные структуры своих собственных тканей. При этом, что очевидно, деструктивного ответа против собственных тканей в норме лимфоциты не развивают. Следовательно, факт комплементарного взаимодействия Рц лимфоцита для Аг с лигандом ещё не достаточен для того, чтобы лимфоцит начал иммунный ответ на уничтожение. Лимфоциту необходима информация (и значительная по объёму) о патогенности лиганда, которую он получает от клеток, осуществляющих доиммунное воспаление в очаге повреждения в покровных тканях — дендритных клеток, макрофагов, клеток эндотелия, тучных клеток, покровного эпителия, фибробластов.
Какие же Рц на клетках доиммунной резистентности, или растворимые Рц, распознают патогены, и что именно они распознают? Отдельные факты по этому вопросу известны давно, но как цельный процесс явление доиммунного воспаления находится в стадии активного изучения и в настоящее время. В поле зрения попали на сегодня два типа Рц, обеспечивающих информирование организма о проникновении патогена. Первый тип — растворимые Рц для патогенов — C1q комплемента, ЛПC–связывающий протеин, связывающий маннозу лектин, C–реактивный белок (СРБ). Эти белки жидких сред организма непосредственно связывают, т.е. распознают микробные продукты. Для «хвостов» этих молекул есть специальные Рц на мембранах фагоцитов, что обеспечивает «передачу информации» о патогене из раствора в клетки доиммунного воспаления.
Второй тип Рц для патогенов — Рц, встроенные во внешнюю мембрану дендритных клеток и макрофагов. Они получили название TOLL и TOLL–подобных (TLR) Рц. Какие-то из мембранных Рц сами непосредственно связывают продукты патогенов (Рц для маннозы макрофагов, TLR2, TLR9 и другие TLR дендритных клеток). Какие-то из TOLL–подобных Рц работают в мембране кооперативно с другими Рц и только обеспечивают проведение сигналов о патогенах в клетку. Например, Рц CD14 макрофагов связывает комплексы бактериального ЛПС с ЛПC–связывающим белком сыворотки, a TLR4 вступает в кооперативное взаимодействие с оккупированным CD14 и обеспечивает конкретный путь проведения сигнала об ЛПС во внутренней среде внутрь клетки. Именно Рц, непосредственно связывающие микробов и их растворимые продукты, очевидно, являются носителями эволюционной памяти многоклеточных о том, что «не своё — чужое!». Чарльз Джанвей ввел понятие PRR (Pattern Recognition Receptors) — Рц, распознающие «узор» на поверхности патогена. На поверхности микроорганизмов (вероятно всех) присутствуют повторяющиеся молекулярные углеводные и липидные структуры. В подавляющем большинстве случаев таких структур нет на клетках организма хозяина. Следовательно, по ним и можно распознать микробные клетки. У млекопитающих известны по крайней мере 4 растворимые молекулы, являющиеся непосредственными Рц для микробных структур. Это белки сыворотки крови, синтезируемые печенью: СМЛ (связывающий маннозу лектин), CРБ (C–реактивный белок), LBP (липополисахаридсвязывающий белок), а также компонент системы комплемента C1q. СМЛ и CРБ — белки острой фазы. СМЛ и C1q — лектины, принадлежащие к семейству коллектинов. Все коллектины имеют по нескольку доменов (от 2 до 6), связывающих углеводы. СМЛ реагирует с углеводами, содержащими остатки маннозы и фукозы в определённой стереоориентации.
Дата добавления: 2016-07-18; просмотров: 2232;











