Закон радиоактивного распада.
Радиоактивность — это испускание ядрами некоторых элементов различных частиц, сопровождающееся переходом ядра в другое состояние и изменением его параметров. Явление радиоактивности было открыто опытным путем французским ученым Анри Беккерелем в 1896 г. для солей урана. Беккерель заметил, что соли урана засвечивают завернутую во много слоев фотобумагу невидимым проникающим излучением.
Английский физик Э. Резерфорд исследовал радиоактивное излучение в электрических и магнитных полях и открыл три составляющие этого излучения, которые были названы а-, B-, у-излучением (рис. 54).
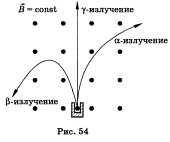 а-Распад представляет собой излучение а-частиц (ядер гелия) высоких энергий. При этом масса ядра уменьшается на 4 единицы, а заряд — на 2 единицы. B-Распад — излучение электронов, заряд которых возрастает на единицу, массовое число не изменяется. у-Излучение представляет собой испускание возбужденным ядром квантов света высокой частоты. Параметры ядра при у-излучении не меняются, ядро лишь переходит в состояние с меньшей энергией. Распавшееся ядро тоже радиоактивно, т. е. происходит цепочка последовательных радиоактивных превращений. Процесс распада всех радиоактивных элементов идет до свинца. Свинец — конечный продукт распада.
а-Распад представляет собой излучение а-частиц (ядер гелия) высоких энергий. При этом масса ядра уменьшается на 4 единицы, а заряд — на 2 единицы. B-Распад — излучение электронов, заряд которых возрастает на единицу, массовое число не изменяется. у-Излучение представляет собой испускание возбужденным ядром квантов света высокой частоты. Параметры ядра при у-излучении не меняются, ядро лишь переходит в состояние с меньшей энергией. Распавшееся ядро тоже радиоактивно, т. е. происходит цепочка последовательных радиоактивных превращений. Процесс распада всех радиоактивных элементов идет до свинца. Свинец — конечный продукт распада.
Приборы, применяемые для регистрации ядерных излучений, называются детекторами ядерных излучений. Наиболее широкое применение получили детекторы, обнаруживающие ядерные излучения по производимой ими ионизации и возбуждению атомов вещества: газоразрядный счетчик Гейгера, камера Вильсона, пузырьковая камера. Существует также метод фотоэмульсий, основанный на способности пролетающей частицы создавать в фотоэмульсии скрытое изображение. След пролетевшей частицы виден на фотографии после проявления.
Радиоактивные излучения оказывают сильное биологическое действие на ткани живого организма, заключающееся в ионизации атомов и молекул среды. Возбужденные атомы и ионы обладают сильной химической активностью, поэтому в клетках организма появляются новые химические соединения, чуждые здоровому организму. Под действием ионизирующей радиации разрушаются сложные молекулы и элементы клеточных структур. В человеческом организме нарушается процесс кроветворения, приводящий к дисбалансу белых и красных кровяных телец. Человек заболевает белокровием, или так называемой лучевой болезнью. Большие дозы облучения приводят к смерти.
Билет№6
1. Уравнение состояния идеального газа ( уравнение Менделеева – Клапейрона). Универсальная газовая постоянная. Изотермический процесс, изохорный процесс, изобарный процесс.
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа состояние газа описывается уравнением Менделеева—Клапейрона: pV = mRT/M, где р — давление, V — объем, m — масса, М — молярная масса, R — универсальная газовая постоянная. Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К (R = 8,31 ДжДмоль • К)).
Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра. Особую роль в физике и технике играют три процесса: изотермический, изохорный и изобарный.
Изопроцессом называют процесс, происходящий с данной массой газа при одном постоянном параметре — температуре, давлении или объеме. Из уравнения состояния как частные случаи получаются законы для изопроцессов.
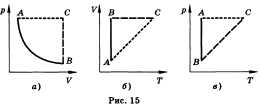
Изотермическим называют процесс, протекающий при постоянной температуре. Т = const. Он описывается законом Бойля—Мариотта: pV = const.
Изохорным называют процесс, протекающий при постоянном объеме. Для него справедлив закон Шарля: V = const, p/T = const.
Изобарным называют процесс, протекающий при постоянном давлении. Уравнение этого процесса имеет вид V/T = const прир = const и называется законом Гей-Люссака. Все процессы можно изобразить графически (рис. 15).
Реальные газы удовлетворяют уравнению состояния идеального газа при не слишком высоких давлениях (пока собственный объем молекул пренебрежительно мал по сравнению с объемом сосуда,
в котором находится газ) и при не слишком низких температурах (пока потенциальной энергией межмолекулярного взаимодействия можно пренебречь по сравнению с кинетической энергией теплового движения молекул), т. е. для реального газа это уравнение и его следствия являются хорошим приближением.
Дата добавления: 2016-07-18; просмотров: 2178;











