Звуковые волны. Скорость звука. Громкость звука и высота тона.
Процессы сжатия и разрежения в воздуха распространяются во все стороны и называются звуковыми волнами. Звуковые волны являются продольными. Скорость звука зависит, как и скорость любых волн, от среды. В воздухе скорость звука 331 м/с, в воде – 1500 м/с, в стали – 6000 м/с. Звуковое давление – дополнительно давление в газе или жидкости, вызываемое звуковой волной. Интенсивность звука измеряется энергией, переносимой звуковыми волнами за единицу времени через единицу площади сечения, перпендикулярного направлению распространения волн, и измеряется в ваттах на квадратный метр. Интенсивность звука определяет его громкость. Высота звука определяется частотой колебаний. Ультразвуком и инфразвуком называют звуковые колебания, лежащие вне пределов слышимости с частотами 20 килогерц и 20 герц соответственно.
Билет№8
- Идеальный газ. Основное уравнение МКТ идеального газа. Температура и ее измерение. Абсолютная температурная шкала.
Идеальным принято считать газ, если: а) между молекулами отсутствуют силы притяжения, т. е. молекулы ведут себя как абсолютно упругие тела;
б) газ очень разряжен, т.е. расстояние между молекулами намного больше размеров самих молекул; в) тепловое равновесие по всему объему достигается мгновенно. Условия, необходимые для того, чтобы реальный газ обрел свойства идеального, осуществляются при соответствующем разряжении реального газа. Некоторые газы даже при комнатной температуре и атмосферном давлении слабо отличаются от идеальных. Основными параметрами идеального газа являются давление, объем и температура.
Одним из первых и важных успехов МКТ было качественное и количественное объяснение давления газа на стенки сосуда. Качественное объяснение заключается в том, что молекулы газа при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела и передают свои импульсы стенкам сосуда.
На основании использования основных положений молекулярно-кинетической теории было получено основное уравнение МКТ идеального газа, которое выглядит так: 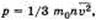 , где р — давление идеального газа, m0 — масса молекулы,
, где р — давление идеального газа, m0 — масса молекулы, 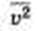 среднее значение концентрация молекул, квадрата скорости молекул.
среднее значение концентрация молекул, квадрата скорости молекул.
Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа 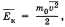 получим основное уравнение МКТ идеального газа в виде:
получим основное уравнение МКТ идеального газа в виде: 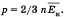 Однако, измерив только давление газа, невозможно узнать ни среднее значение кинетической энергии молекул в отдельности, ни их концентрацию. Следовательно, для нахождения микроскопических параметров газа нужно измерение еще какой-то физической величины, связанной со средней кинетической энергией молекул. Такой величиной является температура. Температура — скалярная физическая величина, описывающая состояние термодинамического равновесия (состояния, при котором не происходит изменения микроскопических параметров). Как термодинамическая величина температура характеризует тепловое состояние системы и измеряется степенью его отклонения от принятого за нулевое, как молекулярно-кинетиче-ская величина — характеризует интенсивность хаотического движения молекул и измеряется их средней кинетической энергией. Ек = 3/2 kT, где k = 1,38 • 10^(-23) Дж/К и называется постоянной Больцмана.
Однако, измерив только давление газа, невозможно узнать ни среднее значение кинетической энергии молекул в отдельности, ни их концентрацию. Следовательно, для нахождения микроскопических параметров газа нужно измерение еще какой-то физической величины, связанной со средней кинетической энергией молекул. Такой величиной является температура. Температура — скалярная физическая величина, описывающая состояние термодинамического равновесия (состояния, при котором не происходит изменения микроскопических параметров). Как термодинамическая величина температура характеризует тепловое состояние системы и измеряется степенью его отклонения от принятого за нулевое, как молекулярно-кинетиче-ская величина — характеризует интенсивность хаотического движения молекул и измеряется их средней кинетической энергией. Ек = 3/2 kT, где k = 1,38 • 10^(-23) Дж/К и называется постоянной Больцмана.
Температура всех частей изолированной системы, находящейся в равновесии, одинакова. Измеряется температура термометрами в градусах различных температурных шкал. Существует абсолютная термодинамическая шкала (шкала Кельвина) и различные эмпирические шкалы, которые отличаются начальными точками. До введения абсолютной шкалы температур в практике широкое распространение получила шкала Цельсия (за О °С принята точка замерзания воды, за 100 °С принята точка кипения воды при нормальном атмосферном давлении).
Единица температуры по абсолютной шкале называется Кельвином и выбрана равной одному градусу по шкале Цельсия 1 К = 1 °С. В шкале Кельвина за ноль принят абсолютный ноль температур, т. е. температура, при которой давление идеального газа при постоянном объеме равно нулю. Вычисления дают результат, что абсолютный нуль температуры равен -273 °С. Таким образом, между абсолютной шкалой температур и шкалой Цельсия существует связь Т = t °C + 273. Абсолютный нуль температур недостижим, так как любое охлаждение основано на испарении молекул с поверхности, а при приближении к абсолютному нулю скорость поступательного движения молекул настолько замедляется, что испарение практически прекращается. Теоретически при абсолютном нуле скорость поступательного движения молекул равна нулю, т. е. прекращается тепловое движение молекул.
2. Спектры испускания и поглощения. Спектральный анализ.
Спектр излучения (или поглощения) — это набор волн определенных частот, которые излучает (или поглощает) атом данного вещества.
Спектры бывают сплошные, линейчатые и полосатые.
Сплошные спектры излучают все вещества, находящиеся в твердом или жидком состоянии. Сплошной спектр содержит волны всех частот видимого света и поэтому выглядит как цветная полоса с плавным переходом от одного цвета к другому в таком порядке: Красный, Оранжевый, Желтый, Зеленый, Синий и Фиолетовый (Каждый Охотник Желает Знать, где Сидит Фазан).
Линейчатые спектры излучают все вещества в атомарном состоянии. Атомы всех веществ излучают свойственные только им наборы волн вполне определенных частот. Как у каждого человека свои личные отпечатки пальцев, так и у атома данного вещества свой, характерный только ему спектр. Линейчатые спектры излучения выглядят как цветные линии, разделенные промежутками. Природа линейчатых спектров объясняется тем, что у атомов конкретного вещества существуют только ему свойственные стационарные состояния со своей характерной энергией, а следовательно, и свой набор пар энергетических уровней, которые может менять атом, т. е. электрон в атоме может переходить только с одних определенных орбит на другие, вполне определенные орбиты для данного химического вещества.
Полосатые спектры излучаются молекулами. Выглядят полосатые спектры подобно линейчатым, только вместо отдельных линий наблюдаются отдельные серии линий, воспринимаемые как отдельные полосы.
Характерным является то, что какой спектр излучается данными атомами, такой же и поглощается, т. е. спектры излучения по набору излучаемых частот совпадают со спектрами поглощения. Поскольку атомам разных веществ соответствуют свойственные толькоим спектры, то существует способ определения химического состава вещества методом изучения его спектров. Этот способ называется спектральным анализом. Спектральный анализ применяется для определения химического состава ископаемых руд при добыче полезных ископаемых, для определения химического состава звезд, атмосфер, планет; является основным методом контроля состава вещества в металлургии и машиностроении.
Билет№9
Дата добавления: 2016-07-18; просмотров: 2861;











