Зависимость скорости реакции от температуры
С ростом температуры скорость большинства реакций увеличивается. Эту закономерность выражена эмпирическим правилом Вант-Гоффа:при повышении температуры на 10 K скорость большинства реакций возрастает в 2 – 4 раза:
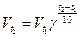
где 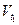 и
и 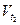 – скорости реакции при температурах t1 и t2 соответственно; t1 и t2 – температуры, при которых проводится реакция; γ – температурный коэффициент скорости реакции.
– скорости реакции при температурах t1 и t2 соответственно; t1 и t2 – температуры, при которых проводится реакция; γ – температурный коэффициент скорости реакции.
Из приведенного уравнения следует, что температурный коэффициент скорости реакции γ равен отношению скоростей 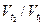 при t2–t1=10 К, т.е. коэффициент γ показывает, во сколько раз увеличивается скорость реакции при изменении температуры на 10 К. Для большинства реакций γ принимает значения от 2 до 4, однако существует значительное число отступлений от этого диапазона. Известны даже реакции с отрицательным температурным коэффициентом – при повышении температуры они замедляются, например,
при t2–t1=10 К, т.е. коэффициент γ показывает, во сколько раз увеличивается скорость реакции при изменении температуры на 10 К. Для большинства реакций γ принимает значения от 2 до 4, однако существует значительное число отступлений от этого диапазона. Известны даже реакции с отрицательным температурным коэффициентом – при повышении температуры они замедляются, например,
2 NO + O2 = 2 NO2.
При концентрациях реагирующих веществ 1 моль/л скорость реакции численно равна константе скорости k, и тогда уравнение можно записать в следующем виде:
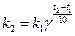 .
.
Это уравнение показывает, что константа скорости реакции зависит от температуры так же, как и скорость реакции.
Функциональную зависимость константы скорости реакции от температуры установил шведский ученый С.Аррениус (1889 г.)
Скорость реакции зависит от числа соударений участвующих в реакции частиц (атомов, молекул, ионов). Число столкновений, испытываемых каждой молекулой газа в обычных условиях, очень велико и достигает десятков миллиардов в секунду. Конечно, не каждое столкновение приводит к химическому взаимодействию. Аррениус высказал гипотезу о том, что химическое взаимодействие осуществляется только между теми соударяющимися молекулами, которые достигли определенного энергетического уровня, характерного для данной реакции, ее энергии активации (EA). Если считать такие молекулы активными, то эффективные столкновения, приводящие к химическому взаимодействию, происходят только между активными молекулами, а доля активных молекул, т.е. отношение числа активных молекул к общему числу молекул очень мало и составляет 3,6∙10–11 – 5,2∙10–19. Продолжительность соприкосновения молекул при их соударении чрезвычайно мало и составляет порядка 10–13 с. Это время – продолжительность элементарного химического акта между отдельными молекулами, и если за приведенный отрезок времени не произойдет реакция, то они вновь отталкиваются друг от друга неизмененными, такие молекулы называются неактивными.
Неактивные молекулы можно активировать, если придать им дополнительную энергию, например, путем увеличения температуры системы. Чем выше температура, тем больше частиц имеет энергию, большую или равную EA. Поэтому скорость реакции увеличивается с повышением температуры. Константа скорости химической реакции определяется числом эффективных столкновений, т.е. числом активных молекул, способных вступить в химическую реакцию.
Зависимость константы скорости реакции от температуры и энергии активации выражается уравнением Аррениуса:
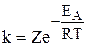 ,
,
где k – константа скорости реакции; Z – постоянная, называемая стерическим фактором и зависящая от числа столкновений, приводящих к реакции; е – основание натурального логарифма (е = 2,7183...); 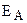 – энергия активации, Дж/моль; R – газовая постоянная (R = 8,314 Дж/К·моль), Т – температура, К.
– энергия активации, Дж/моль; R – газовая постоянная (R = 8,314 Дж/К·моль), Т – температура, К.
При комнатной температуре обычно проходят реакции, для которых EA=60–105 кДж/моль.
На рис. 2 схематически представлены энергетические соотношения при элементарном акте химического взаимодействия. Это изменение энергии в ходе химической реакции, при этом молекулам, вступающим в химическое взаимодействие, необходимо преодолеть энергетический барьер – энергию активации реакции, которая может существенно различаться для экзотермической и эндотермической реакций.
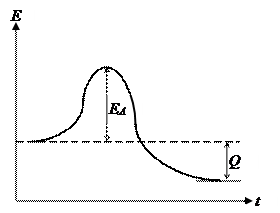
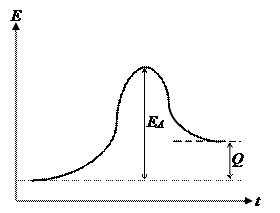
а б
Рис. 2. Энергетическая диаграмма реакций: а) экзотермической; б) эндотермической,
где ЕА – энергия активация реакций; Q – тепло, выделяющееся (а) или поглощающееся (б) в ходе реакции.
Дата добавления: 2020-07-18; просмотров: 626;











