ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
Химическая кинетика – учение о механизме и скорости химических реакций и зависимости этой скорости от различных факторов. Основная задача химической кинетики – управление химическим процессом с целью обеспечения большей скорости реакции и максимально высокого выхода целевого продукта. Изучение механизма химических реакций и всех факторов, влияющих на их протекание, исключительно важно для управления химическими процессами, это позволяет рационально строить технологические процессы и получать в промышленных масштабах важные для народного хозяйства и подчас весьма сложные по составу вещества.
Скоростью химической реакции называется изменение количества реагирующего вещества за единицу времени в единице реакционного пространства.
Скорость химической зависит от многих факторов: природы реагирующих веществ и их фазового состояния, концентраций реагирующих веществ, температуры, присутствия катализатора и др.
Реакции, протекающие в однофазной (однородной) системе, например, жидкой или газообразной, называются гомогенными. Такие реакции протекают во всем объеме системы. Скорость гомогенных реакций определяется изменением концентрации реагирующих веществ в единице объёма за единицу времени:
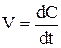 ,
,
где V – скорость реакции; C – молярная концентрация, моль/л; t – время, с.
Реакции, протекающие в многофазных системах (состоящих из двух или более фаз, например, газообразной и твердой фазы) называются гетерогенными. Такие реакции протекают только на поверхности раздела фаз. Скорость гетерогенной реакции определяется изменением концентрации реагирующих веществ на единице поверхности в единицу времени.
Механизм реакции – это совокупность стадий химической реакции, в результате которых исходные вещества превращаются в продукты реакции. Реакции могут быть одностадийными и многостадийными. Скорость реакции определяется скоростью самой медленной ее стадии (лимитирующей стадии).
Рассмотрим гомогенную реакцию, которая происходит в газовой фазе. Необходимым условием химического взаимодействия молекул является их столкновение. Столкновение молекул в некотором реакционном пространстве при заданной температуре происходит тем чаще, чем больше этих молекул. Поэтому скорость химической реакции напрямую зависит от концентрации реагирующих веществ.
Профессор Н.Н. Бекетов в 1865 г. впервые высказал гипотезу о зависимости между массами реагентов и временем течения реакции: «…притяжение пропорционально произведению действующих масс». Эта гипотеза нашла подтверждение в законе действующих масс, который был установлен в 1867 г. норвежскими химиками К. Гульдбергом и П. Вааге. Современная формулировка закона действующих масстакова: скорость химической реакции прямо пропорциональна концентрациям реагирующих веществ, взятым в степенях, равных соответствующим стехиометрическим коэффициентам в уравнении реакции.
Для реакции
aA + bB ⇄ cC + dD,
закон действующих масс имеет вид:
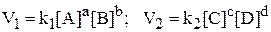 ,
,
где А и B – исходные вещества; D и С – продукты реакции; a, b, c, d – стехиометрические коэффициенты в уравнении реакции.
Эти уравнения называются кинетическими. В них V1 и V2 – скорости прямой и обратной реакции; k1 и k2 – константы скорости прямой и обратной реакции соответственно; [A], [B], [C], [D] – концентрации соответствующих веществ. Константа скорости реакции k определяется природой реагирующих веществ и зависит от температуры, присутствия катализатора, но не зависит от концентрации веществ, участвующих в реакции. Если концентрации реагирующих веществ равны 1 моль/л, то константа скорости k численно равна скорости реакции. Для гетерогенных реакций кинетические уравнения записываются без учета концентраций твердых веществ, потому что концентрации твердых веществ не меняются в ходе реакции (остаются постоянными) и не влияют на скорость реакции, например,
2NO(Г) + Н2(Г) = 2N2O(Г) + H2O(Г); (1) С(Т) + O2(Г) = СO2(Г) (2)
V1 = k1[NO]2[H2]; 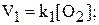
V2 = k2[N2O]2[H2O]; V2= k2[CO2].
Показатель степени при концентрации в кинетическом уравнении называется порядком реакции по данному компоненту. Например, порядок реакции (1) по оксиду азота (II) (NO) равен 2, а по водороду – 1. Для обратной реакции порядок по оксиду азота (I) (N2O) равен 2, для паров воды (Н2О) – 1. Для гетерогенной реакции (2) порядок по кислороду для прямой реакции и по углекислому газу для обратной реакции равен 1. При этом твердый углерод не учитывается при записи кинетического уравнения. Сумма показателей степеней при концентрациях в кинетическом уравнении называется порядком реакции. Для реакции (1) порядок равен: 1 + 2 = 3.
В многостадийных реакциях порядок реакции может быть дробным, но не более трех.
Молекулярность реакции определяется числом частиц, участвующих в элементарном акте химического взаимодействия. По этому признаку реакции разделяются на мономолекулярные, бимолекулярные и тримолекулярные. Примером мономолекулярной реакции может служить термическая диссоциация йода: I2® 2I; бимолекулярной – разложение йодида водорода: 2HI ® H2 + I2; тримолекулярной – взаимодействие оксида азота с водородом: 2NO + Н2® 2N2O + H2O. Тримолекулярные реакции встречаются крайне редко, т.к. столкновение одновременно трёх молекул маловероятно. Реакции с более высокой молекулярностью практически неизвестны.
В простых реакциях, протекающих в одну стадию, порядок совпадает с молекулярностью. Закон действующих масс справедлив для простых реакций. В случае сложных реакций, протекающих в несколько стадий, закон применим к любой отдельной реакции, но не к их сумме.
Дата добавления: 2020-07-18; просмотров: 525;











