КИНЕТИКА ДЕЗАКТИВАЦИИ
Для того чтобы получить кинетическое описание процесса дезактивации необходимо точно знать механизм всех дезактивационных процессов, протекающих на данном катализаторе в условиях данной реакции.
Иногда для количественного описания процесса дезактивации достаточно применения моделей основанных на упрощенном подходе к механизму дезактивации.
Если предположить, что скорость гетерогеннокаталитической реакции подчиняется кинетике Лэнгмюра-Хиншельвуда и пропорциональна концентрации активных центров на поверхности катализатора (ZС):
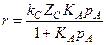 (4-3)
(4-3)
где kС - константа скорости, отнесенная к одному каталитическом центру.
то изменение активности катализатора (см. уравнение 4-2) будет определяться изменением концентрации активных центров, то есть ZС.
Скорость дезактивации (rd) - это изменение активности (a) в единицу времени, которая в рассматриваемом случае равна изменению концентрации активных центров в единицу времени:
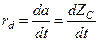 (4-4)
(4-4)
Скорость дезактивации в самом общем случае зависит от температуры, энергии активации процесса дезактивации (Еd), концентрации активных центров и концентрации дезактивирующих агентов (Сd):
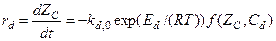 (4-5)
(4-5)
Для примера: в модельной реакции реформинга гептана на Pt/Al2O3 , Еd имеет достаточно высокое значение около 290 кДж/моль.
Если для конкретизации вида кинетического уравнения дезактивации применить закон действующих масс, то уравнение (4-5) запишется в следующем общем виде:
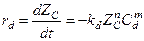 (4-6)
(4-6)
Предположим, что дезактивация катализатора происходит в результате спекания, скорость которого пропорциональна концентрации кристаллитов (активных центров), то есть n = 1, а отравление катализатора отсутствует, то есть m = 0, тогда:
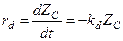
Интегрируя это уравнение получим функцию изменения ZС от времени работы катализатора:
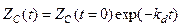 (4-7)
(4-7)
То есть происходит экспоненциальное падение каталитической активности во времени. Аналогичное изменение активности будет наблюдаться в случае отсутствия спекания, но при наличии отравления катализатора при постоянной концентрации яда (Сd = const). Примером служат: гидрирование этилена на медном катализаторе и дегидрирование алканов на Cr/Al2O3.
При спекании часто скорость дезактивации пропорциональна квадрату концентрации каталитических центров:
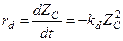
Интегрирование этого уравнения дает следующий результат:
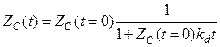 (4-8)
(4-8)
Примером такой дезактивации служит дегидрирование циклогексана на Pt/Al2O3 и гидрирование изобутилена на никелевом катализаторе.
В зависимости от причины дезактивации и условий процесса потеря активности может протекать как очень медленно, в течении нескольких лет, так и очень быстро, в считанные минуты (см. таблицу 4-27). Когда показатели процесса падают до неприемлемого уровня катализатор подвергают регенерации. На практике из-за необратимой дезактивации регенерация не приводит к полному восстановлению показателей катализатора (активности, селективности) до уровня свежего катализатора. Схематично изменение каталитической активности в циклах "эксплуатация-регенерация" представлено на рисунке 4-46. Когда регенерация катализатора становится экономически не выгодна, катализатор полностью меняют на новый.
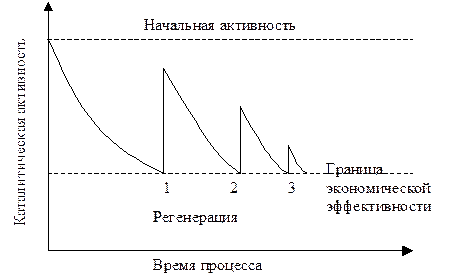
Рис. 4-46. Изменение каталитической активности в течении процесса.
Таким образом детальное знание механизма и кинетики дезактивации необходимо для моделирования поведения катализатора в процессе эксплуатации и оптимизации условий каталитического процесса.
Дата добавления: 2020-07-18; просмотров: 684;











