Кинетика восстановления закиси-окиси урана водородом
Скорость восстановления закиси-окиси урана определяется прежде всего температурой (табл. 1.2.9).
В соответствии с приведенными данными, начиная примерно с температуры 630 °С скорость реакции восстановления мало зависит от температуры, в связи с чем на практике процесс восстановления ведут, как правило, при 650-700 °С.
По данным таблицы нельзя судить об изменении скорости восстановительного процесса по мере превращения закиси-окиси урана в диоксид; это можно сделать лишь на основе анализа гравиметрических кривых (рис. 1.2.4 и 1.2.5).
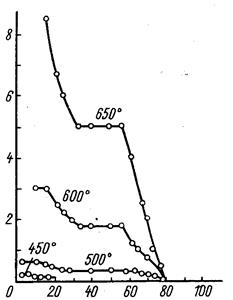
Как видно из рисунков, при давлении водорода 200 мм рт. ст.и температуре 600 °C и ниже начальный этап восстановления протекает с некоторой постоянной скоростью.
При 600 и 500 °С постоянство скорости сохраняется до образования твердого продукта состава UО2,55, а при 450 °С – UО2,62. После этого по мере дальнейшего хода процесса скорость падает. При всех температурах падение скорости продолжается до образования UО2,45; затем процесс развивается с некоторой новой постоянной скоростью. Горизонтальный участок кинетической кривой, соответствующий этому этапу восстановления, заканчивается образованием продукта состава UO2,3 – UO2,28. На последнем этапе восстановления скорость постепенно падает практически до нуля. При 650 °С картина несколько изменяется. Процесс начинается с максимальной скоростью, которая постепенно уменьшается. Уменьшение скорости прекращается при достижении состава UО2,45. Последующие этапы восстановления аналогичны уже рассмотренным.
Таблица 1.2.9
Влияние температуры на скорость восстановления закиси-окиси урана
водородом*
| Температура, °С | Скорость реакции восстановления закиси-окиси урана, моль Н2/моль U в 1 мин | Температура, °С | Скорость реакции восстановления закиси-окиси урана, моль Н2/моль U в 1 мин |
| 0,0021 0,0034 0,0067 0,0135 0,0320 | 0,0371 0,0467 0,0490 0,0473 |
* Реакция восстановления проведена при постоянном парциальном давлении водорода 400 мм рт. ст.; закись-окись урана получена ступенчатым прокаливанием пероксида урана сначала при 250-300 °С до UO3· 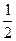 Н2О, а затем при 800 °C до U3O8.
Н2О, а затем при 800 °C до U3O8.
При давлении водорода 50 мм рт. ст. и температуре 650 °С и ниже в начале восстановления скорость возрастает по мере развития процесса. Затем восстановление протекает с некоторой постоянной скоростью; в дальнейшем процесс идет так же, как при давлении водорода 200 мм рт. cт.
При 700 °С и давлении водорода 50 мм. рт. cm. процесс восстановления протекает с постоянной скоростью до достижения степени восстановления, равной 70 %.
Кажущаяся энергия активации (Ea) при давлении водорода 200 мм рт. ст.и степени восстановления 40 % равна 86,31 кДж/моль; при степени восстановления 10 % она составляет 89,67 кДж/моль. При давлении водорода 50 мм рт. ст.и степени восстановления 40 % кажущаяся энергия активации равна 63,69 кДж/моль, при степени восстановления 15 % она составляет 72,94 кДж/моль.
Значительное влияние на скорость процесса восстановления закиси-окиси оказывает парциальное давление водорода. Данные по скорости восстановления приведены на рис. 1.2.6.
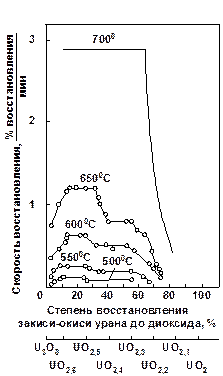 Рис. 1.2.4 Зависимость скорости реакции, восстановления закиси-окиси урана водородом от температуры и степени восстановления (парциальное давление водорода 50 мм рт. ст.).
Рис. 1.2.4 Зависимость скорости реакции, восстановления закиси-окиси урана водородом от температуры и степени восстановления (парциальное давление водорода 50 мм рт. ст.).
|
|
| Степень восстановления, % восстановления/мин |
| Степень восстановления закиси-окиси, % |
Рис. 1.2.5 Зависимость скорости реакции восстановления закиси-окиси урана водородом от температуры и степени восстановления (парциальное давление водорода 200 мм. рт. ст.).
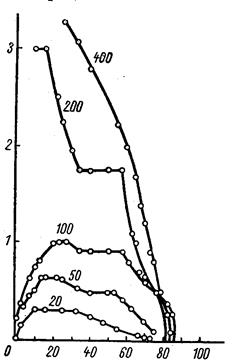
В соответствии с данными, приведенными на рис. 1.2.6, при 600 °С и давлении водорода 400 мм рт. ст. восстановление начинается с максимальной скоростью, которая затем непрерывно уменьшается до практически полного прекращения процесса. При более низком парциальном давлении водорода отмечаются примерно те же закономерности, которые подробно обсуждены выше.
|
| Скорость восстановления, % восстановления/мин |
| Степень восстановления закиси-окиси, % |
Рис. 1.2.6 Зависимость скорости реакции восстановления закиси-окиси урана водородом от парциального давления водорода и от степени восстановления при различных значениях парциального давления (мм. рт. ст.); температура 600 °С
Давление водорода выше 300-400 мм рт. ст. сравнительно мало сказывается на начальной скорости процесса.
«Фазовые» превращения в процессе восстановления закиси-окиси урана до диоксида при температуре 500 °С и выше отвечают схеме:
U3O8 → UО2,6±x → UО 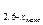 → U4О9 → UО2+х → UO2, (1.2.18)
→ U4О9 → UО2+х → UO2, (1.2.18)
где хмакс = 0,16-0,14.
Переход U3O8 в фазу UО2,6±x совершается в кинетическом режиме; лимитирующей стадией является поверхностная реакция между адсорбированным водородом и кислородом оксида. Скорость этой реакции прямо пропорциональна концентрации водорода и кислорода на поверхности оксида. Концентрация же адсорбированного водорода при заданных температуре и давлении в значительной степени зависит от адсорбционной способности поверхности оксида. Последняя чрезвычайно чувствительна к структурным нарушениям в кристалле.
В процессе отщепления кислорода от оксида, т. е. его восстановления, нарушается упорядоченная структура кристалла и непрерывно образуются новые активные центры. Рост числа их способствует адсорбции водорода, увеличению его концентрации на поверхности оксида, а тем самым и увеличению скорости поверхностной реакции. В то же время уменьшается концентрация кислорода в поверхностном слое оксида, что вызывает падение скорости поверхностной реакции. Следовательно, одновременно действуют два фактора в двух взаимно противоположных направлениях.
В самом начале восстановления решающее значение имеет увеличение числа активных центров, образование которых происходит по цепному механизму; поэтому скорость поверхностной реакции, а следовательно, и суммарная скорость процесса возрастают по мере увеличения степени восстановления. Этим объясняется наличие участка с возрастающей скоростью при давлении водорода 50 мм рт. ст. При 200 мм рт. ст. этот этап протекает чрезвычайно быстро. В известный момент времени действие двух указанных факторов уравновешивается, и процесс начинает протекать с постоянной скоростью.
Увеличение числа активных центров на поверхности может происходить только до определенного значения, после чего наблюдается их стабилизация. Концентрация же кислорода в конденсированной фазе по мepe развития процесса непрерывно уменьшается. Этим объясняется тот факт, что конечные этапы восстановления фазы UO2,6±x (постепенный переход в фазу UО 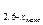 ) во всех случаях протекают с непрерывно уменьшающейся скоростью.
) во всех случаях протекают с непрерывно уменьшающейся скоростью.
Вторые горизонтальные участки кривых соответствуют фазовому переходу UО 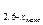 → U4O9. Этот переход совершается с постоянной скоростью в кинетическом режиме. На этом этапе восстановления скорость прямо пропорциональна давлению
→ U4O9. Этот переход совершается с постоянной скоростью в кинетическом режиме. На этом этапе восстановления скорость прямо пропорциональна давлению
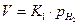 . (1.2.19)
. (1.2.19)
В условиях кинетического режима наличие зависимости скорости от давления указывает на определяющую роль поверхностной реакции. Последний этап восстановления (фазовый переход U4О9 в фазу UО  ) протекает в диффузионном режиме причем определяющей стадией, по-видимому, является диффузия кислорода к месту осуществления поверхностной реакции. В процессе восстановления на этом этапе не происходит значительных изменений в структуре кристаллической решетки и отщепление кислорода должно идти постепенно. Именно поэтому скорость реакции на данном этапе непрерывно падает по мере развития процесса.
) протекает в диффузионном режиме причем определяющей стадией, по-видимому, является диффузия кислорода к месту осуществления поверхностной реакции. В процессе восстановления на этом этапе не происходит значительных изменений в структуре кристаллической решетки и отщепление кислорода должно идти постепенно. Именно поэтому скорость реакции на данном этапе непрерывно падает по мере развития процесса.
Восстановление оксида урана состава U4O9 водородом при температуре 400-600 °C и давлении от 200 до 500 мм рт. ст. протекает до UO2,02±0,02. В процессе восстановления решетка U4O9 изменяется на решетку диоксида урана типа флюорита. Промежуточный продукт восстановления имеет нестехиометрический состав UO2+х, где 0,10 > х > 0,06. Константа скорости восстановления К отвечает эмпирическому уравнению
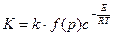 , (1.2.20)
, (1.2.20)
где 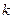 - постоянный множитель;
- постоянный множитель;
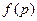 - некоторая функция давления;
- некоторая функция давления;
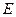 - энергия активации.
- энергия активации.
Для восстановления U4O9 водородом справедливо соотношение:
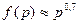 , (1.2.21)
, (1.2.21)
однако значение показателя степени уменьшается с увеличением давления в системе. Энергия активации для восстановления U4O9 равна 104,75± 12,57 кДж/моль.
Скорость восстановления закиси-окиси урана водородом зависит oт размера кристаллов; как правило, с уменьшением размера частиц скорость процесса увеличивается, и лишь для самых тонких порошков этот эффект вследствие частичного спекания оксидов урана нe всегда заметен (табл. 1.2.10).
Таблица 1.2.10
Зависимость скорости восстановления закиси-окиси урана водородом от среднего размера кристаллов *
| Соединение, из которого получена закись-окись урана | Температура получения закиси-окиси урана, °С | Средний размер кристаллов, мкм | Скорость восстановления закиси-окиси урана при 380 °С, моль H2/моль U в 1 мин | Скорость восстановления закиси-окиси урана при 545 °С, моль H2/моль U в 1 мин |
| UO2С2O4 (NH4)2U2O7 UO4·2H2O | < 650 | ~ 0,1 ~ 0,3 ~ 0,5 | 0,0023 0,0010 0,0002 | 0,036 0,057 0,019 |
* Восстановление проведено при постоянном парциальном давлении водорода 400 мм pт. ст.
Дата добавления: 2019-05-21; просмотров: 1125;











