Кинетика восстановления триоксида урана водородом
Скорость восстановления триоксида урана водородом до диоксида определяется теми же факторами, что и скорость восстановления закиси-окиси: температурой, парциальным давлением водорода и физическими характеристиками твердого триоксида урана. Влияние температуры и парциального давления водорода на скорость процесса иллюстрируются данными рис. 1.2.7 и 1.2.8.
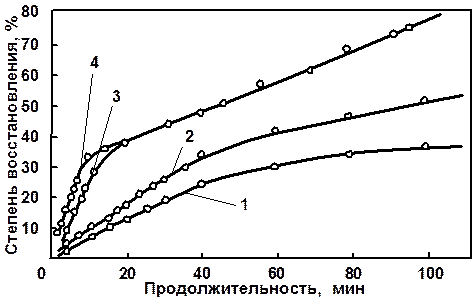
Из рисунков видно, что при всех температурах и давлениях водорода начальный этап восстановления протекает с постоянной скоростью. Величина горизонтальных участков, соответствующих этому этапу, увеличивается с увеличением температуры при постоянном давлении и с увеличением давления при постоянной температуре. При неизменной температуре зависимость скорости процесса от давления водорода на этом этапе описывается уравнением:
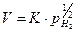 . (1.2.22)
. (1.2.22)
Кажущаяся энергия активации процесса равна 87,2 кДж/моль.
Начиная с некоторой, определенной при данных температуре и давлении степени восстановления, скорость процесса резко падает. Падение скорости происходит при сравнительно небольшом изменении степени восстановления. Конечный этап восстановления характеризуется также постоянной скоростью. Исключение представляют данные, полученные при температуре 500 °С и давлении водорода 200 мм рт. ст. В этом случае после второго горизонтального участка на кривой имеется еще участок, показывающий уменьшение скорости процесса по мере дальнейшего восстановления.
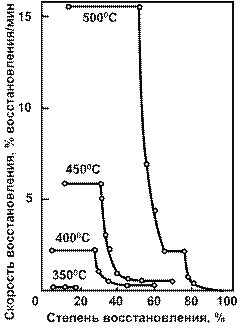 Рис. 1.2.7 Влияние температуры и степени восстановления триокcида урана на скорость; его восстановления водородом. Парциальное давление водорода 200 мм рт. ст.
Рис. 1.2.7 Влияние температуры и степени восстановления триокcида урана на скорость; его восстановления водородом. Парциальное давление водорода 200 мм рт. ст.
|
 Парциальное давление водорода:
1 – 50 мм рт. cт; 2 – 100 мм рт.ст; 3 – 200 мм рт. ст; 4 - 400 мм рт. ст
Рис. 1.2.8 Изменение степени восстановления триокcида урана во времени при различных парциальных давлениях водорода. Температура 400 °С
Парциальное давление водорода:
1 – 50 мм рт. cт; 2 – 100 мм рт.ст; 3 – 200 мм рт. ст; 4 - 400 мм рт. ст
Рис. 1.2.8 Изменение степени восстановления триокcида урана во времени при различных парциальных давлениях водорода. Температура 400 °С
|
Кажущаяся Eа при 70 %-ном восстановлении триоксида урана составляет 125,7 кДж/моль. На этом этапе восстановления зависимость скорости реакции от давления водорода при постоянной температуре и в интервале парциальных давлений 50-200 мм рт. ст. описывается уравнением:
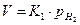 . (1.2.23)
. (1.2.23)
Первые горизонтальные участки соответствуют восстановлению UO3 до U3О8.
Лимитирующей стадией на этом этапе восстановления является поверхностная реакция между водородом, адсорбированным на поверхности, и кислородом оксида. Адсорбция водорода на поверхности триоксида урана протекает достаточно быстро, причем изотерма адсорбции выражается уравнением:
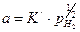 . (1.2.24)
. (1.2.24)
Появление коэффициента 1/2 в этом уравнении объясняется тем, что молекула водорода диссоциирует на атомы. Скорость же поверхностной реакции между адсорбированным водородом и кислородом оксида прямо пропорциональна концентрации водорода на поверхности адсорбента, так как концентрацию кислорода можно считать постоянной величиной. Поскольку эта стадия оказывается лимитирующей, суммарная скорость процесса восстановления пропорциональна давлению водорода в степени 1/2.
Участки кривых, на которых скорость уменьшается с увеличением степени восстановления, соответствуют постепенному переходу закиси-окиси урана в фазу UО2,6±x с минимальным при данной температуре содержанием кислорода. Падение скорости объясняется уменьшением концентрации кислорода в твердой фазе. Вторые горизонтальные участки соответствуют восстановлению фазы UО2,6±x с минимальным содержанием кислорода до тетрагональной фазы. Лимитирующей стадией на данном этапе восстановления является адсорбция водорода на поверхности оксида. Это обстоятельство подтверждается тем, что суммарная скорость восстановления пропорциональна давлению водорода в первой степени.
Восстановительные процессы связаны с изменением размера кристаллов; прокаливание триоксида урана в водороде во всех случаях приводит к измельчению частиц. Примерно то же самое наблюдается и при восстановлении закиси-окиси. Переход же триоксида урана в закись-окись сопровождается укрупнением кристаллов. Отмеченные обстоятельства количественно характеризуются следующими данными:
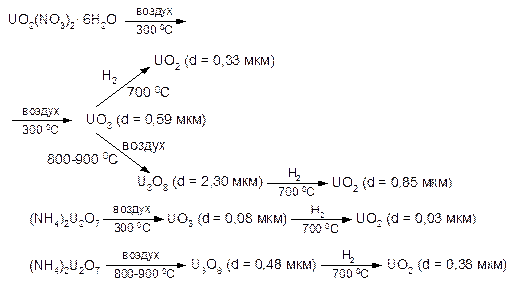
(здесь во всех случаях d - средний размер кристаллов).
Определенное влияние на скорость восстановления триоксида урана оказывают некоторые вещества, присутствующие в исходных образцах. В частности, значительно ускоряется процесс восстановления в присутствии в триоксиде урана до 0,15 % сульфат иона; это объясняется либо напряженным состоянием решетки триоксида, либо разрывом сформированных кристаллитов. Другие примеси, например натрий, калий и кальций (до 0,05 %), а также железо и алюминий (до 0,3 %) практически не вызывают изменения реакционной способности триоксида урана.
Обширные экспериментальные данные по восстановлению триоксида урана водородом могут быть представлены в форме интегральных уравнений, используемых для расчета аппаратов восстановления. В частности, восстановление триоксида урана, полученного из уранилнитрата, описывается уравнением:
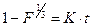 , (1.2.25)
, (1.2.25)
где F – доля непрореагировавшего триоксида урана, доли единицы;
t – время процесса, с (или мин);
К – постоянная, включающая в себя константу скорости реакции.
Это уравнение обычно представляется в иной форме:
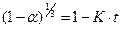 , (1.2.26)
, (1.2.26)
где 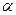 – степень реагирования вещества ко времени t.
– степень реагирования вещества ко времени t.
Данное уравнение, несмотря на свою простоту, довольно удовлетворительно предсказывает скорость процесса при различных условиях.
В заключение отметим, что, если диоксид урана используется для производства тетрафторида урана, триоксид восстанавливают при 625 °С. Полученный диоксид урана сохраняет форму сферических агрегатов триоксида размером около 40 мкм; размер отдельных кристаллов равен или менее 1 мкм.
Если же диоксид урана используется для производства керамических тепловыделяющих элементов, триоксид урана восстанавливают при 800 °С. В результате восстановления получается порошок диоксида урана; средний размер агрегатов 40-60 мкм при размерах кристаллов порядка 0,1 мкм. При холодном прессовании под давлением 3-5 т/см2 получаются таблетки плотностью 5,3-5,7 г/см3. Их последующее спекание в атмосфере водорода или аммиака при температуре около 1600 °С дает материал по плотности, близкой к теоретической.
Дата добавления: 2019-05-21; просмотров: 1118;











