Механизмы реакций, протекающих на поверхности кислотных катализаторов.
Изоляторы: кислотные и основные катализаторы.
Катализаторы, относящиеся к этой группе, не проводят электрический ток (по крайней мере при относительно умеренных температурах катализа), то есть не имеют свободно перемещающихся электронов, и поэтому практически не катализируют редокс-реакции.
Например, твердые оксиды элементов 3-го периода (Na2O, MgO, Al2O3, SiO2, P2O5) являются изоляторами. Как видно, в этом ряду слева направо свойства оксидов меняются от основных через амфотерные до кислотных. Подобным образом ведут себя оксиды других периодов.
Возникающие при хемосорбции заряды на поверхности катализаторов-изоляторов не передаются по катализатору, а локализованы на активных центрах. Поэтому каталитические свойства изоляторов не могут быть в достаточной степени объяснены электронной теорией, а наиболее подходящей концепцией для объяснения каталитических свойств изоляторов является концепция кислот и оснований.
Хорошо известными и наиболее используемыми в промышленном органическом синтезе кислотно-основными катализаторами являются: Al2O3, алюмосиликаты, цеолиты, MgO, SiO2/MgO, силикагели, алюмофосфаты и специальные глины, активированные химической обработкой.
Все эти катализаторы содержат на поверхности кислотные центры.
Доля основных промышленных гетерогенных катализаторов гораздо меньше, чем доля кислотных. В Таблице 5.21 приведены известные кислотно-основные катализаторы.
Таблица 5.21.
Классификация кислотно-основных катализаторов.
| Гетерогенные кислотные катализаторы | Гетерогенные основные катализаторы |
| 1. Индивидуальные оксиды: Al2O3, SiO2, TiO2 2. Смешанные оксиды: Al2O3/SiO2, SiO2/MgO, ZrO2/SiO2, гетерополикислоты (фосфорно-вольфрамовые, фосфорно-молибденовые). 3. Минеральные кислоты (H3PO4, H2SO4) на твердых пористых носителях. 4. Полимерные катионообменные материалы. 5. Соли кислородсодержащих минеральных кислот (фосфаты, сульфаты, вольфраматы) и переходных металлов. 6. Галогениды с Льюисовской кислотностью (AlCl3) на твердых пористых носителях. 7. Цеолиты (в Н-форме). 8. Суперкислоты: ZrO2, TiO2 обработанные серной кислотой. | 1. Оксиды, гидроксиды, амиды щелочных и щелочноземельных металлов (сами по себе и на твердых носителях). 2. Полимерные анионообменные материалы. 3. Щелочные и щелочноземельные соли слабых кислот (карбонаты, силикаты). 4. Супероснования: MgO донированный натрием. |
Кислотные катализаторы.
Оксид алюминия.
Оксидные катализаторы с кислотной поверхностью катализируют многие промышленно-важные реакции (дегидратация спиртов, гидратация олефинов, крекинг, полимеризация олефинов, конденсация карбонильных соединений, этерификация и пр.).
Кислотные центры на поверхности твердых оксидов могут обладать как протонной кислотностью (Бренстеда), так и апротонной кислотностью (Льюиса) (См. п. 2.1.1).
Рассмотрим природу протонных и апротонных кислотных центров на примере оксида алюминия. Al2O3 всегда содержит связанную воду, количество которой сильно зависит от температуры. Свежеприготовленный (свежеосажденный) Al2O3 полностью гидроксилирован на поверхности вплоть до температуры 100оС. В таком состоянии поверхностные -ОН группы ведут себя как слабые кислоты Бренстеда:
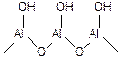 (5.56)
(5.56)
Значительно увеличить кислотность Бренстедовских центров можно замещением части гидроксильных групп на хлорид или фторид анион (обработкой соответствующим галогеноводородом):
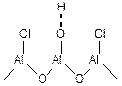 (5.57)
(5.57)
Увеличение кислотности -ОН группы объясняется сильным индукционным эффектом галоген-внионов, находящихся рядом с -ОН группой.
При нагревании гидроксилированного оксида алюминия выше температуры 150оС происходит дегидратация поверхностных и приповерхностных -ОН групп. При этом образуются дегидроксилированные атомы алюминия на поверхности, обладающие средней Льюисовской кислотностью:
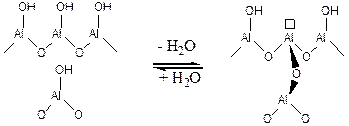 (5.58)
(5.58)
Одновременно с образованием таких Льюисовских центров усиливается кислотность соседних Бренстедовских центров за счет возможного донорно-акцепторного взаимодействия следующего типа:
 (5.59)
(5.59)
При температуре 400оС и выше происходит дегидроксилирование поверхностных атомов алюминия с образованием сильных Льюисовских кислотных и основных центров:
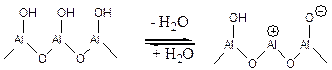 (5.60)
(5.60)
При температуре 900оС поверхность Al2O3 дегидроксилируется полностью и содержит только Льюисовские кислотные и основные центры.
Регулирование силы и соотношения протонных и апротонных кислотных центров, а также основных центров на поверхности Al2O3 очень важно для обеспечения оптимального каталитического эффекта в той или иной реакции. Установлено, что сильные Бренстедовские кислотные центры играют определяющую роль для реакций полимеризации олефинов, диспропорционирования толуола до бензола и ксилолов. Льюисовские кислотные центры являются определяющими в реакции деструкции алканов.
Циклизация олефинов в процессе реформинга протекает при согласованном катализе соседними - основным и протонным кислотным - центрами на поверхности оксида алюминия:
(5.61)
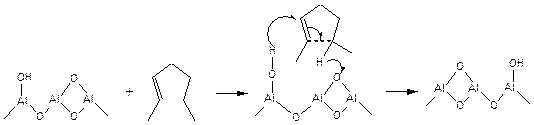

Каталитическое действие гетерогенных кислот и оснований такое же как и у гомогенных. Каталитическая активность коррелирует с кислотностью активных центров в соответствии с уравнением Бренстеда:
lgk = lgG - aH0 (5.62)
Значения функции кислотности центров на поверхности гетерогенного катализатора можно получить экспериментально:
- либо с помощью индикаторов Гаммета;
- либо по ИК-спектрам адсорбированных оснований, таких как аммиак, пиридин, хинолин.
Второй способ основан на том, что комплексы выбранных оснований с кислотами Бренстеда и Льюиса имеют различное строение и поэтому имеют характерные полосы поглощения в разных областях спектра. Общее количество кислотных центров определяют по количеству хемосорбированного аммиака. Затем по интенсивности сигналов в ИК-спектрах можно определить соотношение концентраций протонных и апротонных кислотных центров на поверхности, а по смещению сигнала - силу соответствующих центров.
Например поверхностные соединения и соответствующие характерные частоты в ИК-спектре при использовании в качестве "зонда" пиридина следующие:
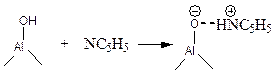
| Бренстедовские центры (5.63) Ион пиридиния n ~ 1540 см-1 |
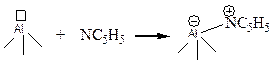
| Льюисовские центры (5.64) кислотно-основный комплекс n ~ 1465 см-1 |
Оксид кремния.
Двуокись кремния (силикагель) является аморфным продуктом поликонденсации кремниевой кислоты с участием силанольных групп (Si-OH) и образованием силоксановых групп (Si-O-Si):
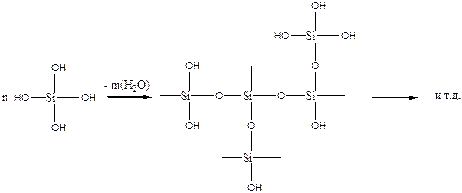 (5.63)
(5.63)
Связь гидроксильных групп с поверхностными атомами кремния в SiO2 гораздо сильнее, чем связь гидроксильных групп с атомами алюминия в Al2O3. Поэтому дегидратация силикагеля при температурах до 120оС сопровождается потерей только физически адсорбированной воды. Дегидроксилирование поверхности оксида кремния начинается только при температурах выше 200оС. При температуре 500оС концентрация поверхностных силанольных групп составляет около 20-30% от начальной, а при 1000оС - 10-15%.
Таким образом, в отличии от оксида алюминия, на поверхности SiO2 Льюисовские центры образуются не так охотно, и при температурах до 300оС практически не обнаруживаются. Поэтому на поверхности оксида кремния доминируют Бренстедовские центры, но кислотность их низка, и сравнима с кислотностью уксусной кислоты. Поэтому сам силикагель, как катализатор не представляет интерес, но является ценным носителем, так как обладает высокой удельной поверхностью (до 800 м2/г).
Алюмосиликаты.
Алюмосиликаты - один из важнейших типов гетерогенных кислотных катализаторов, применяемых в процессах крекинга.
По химическому строению они представляют собой двуокись кремния, в которой часть атомов кремния замещена на атомы алюминия. Трехзарядный ион алюминия на поверхности окружен тремя четырехзарядными ионами кремния, обладающими большей электроотрицательностью. Это приводит в сильному понижению электронной плотности на атоме алюминия и, следовательно, к увеличению его электрофильности (Льюисовской кислотности). В результате молекулы воды подвергаются на поверхности алюмосиликата диссоциативной хемосорбции:
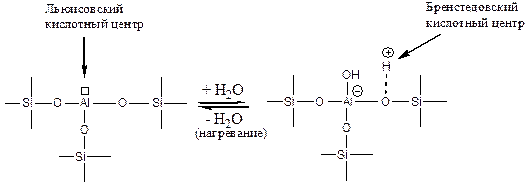 (5.64)
(5.64)
что приводит к образованию сильного протонного кислотного центра. При нагревании до высокой температуры происходит дегидратация поверхности и образование сильного Льюисовского кислотного центра (обратная реакция (5.64)).
Сильная кислотность алюмосиликатов обеспечивается уже при концентрации Al2O3 до 10-12%. Экспериментально установлено, что максимальная кислотность наблюдается при 20-30%-ном содержании Al2O3.
Увеличение кислотности алюмосиликатов можно достичь обработкой их небольшим количеством HCl:
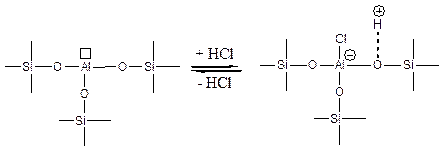 (5.65)
(5.65)
Соотношение концентраций кислотных центров Бренстеда и Льюиса на поверхности алюмосиликатов и их распределение по силе регулируют соотношением SiO2/Al2O3, температурой процесса, обработкой HCl и Na2O. Таким образом удается тонко регулировать активность и селективность катализируемых процессов.
Цеолиты.
Цеолиты, в отличии от Al2O3, SiO2 и алюмосиликатов, которые являются аморфными веществами, - представляют собой водосодержащие кристаллические вещества с высокоупорядоченной структурой. Основным строительным блоком цеолитов является тетраэдр из четырех анионов кислорода, окружающих ион Si4+ или Al3+ (Рис. 5.49). Заряд каждого иона кремния сбалансирован зарядами окружающих ионов кислорода, и, следовательно, кремний содержащие тетраэдры - электронейтральны. А алюминий содержащий тетраэдр имеет избыточный заряд -1, так как катион алюминия имеет заряд +3. Поэтому в состав цеолитов входят катионы, компенсирующие эти отрицательные заряды. Тетраэдры объединяются в блоки по связям -Si-О-Si-, из которых строится структура цеолита. В общем виде химический состав элементарной ячейки цеолита отображается формулой:
Mj/n[(AlO2)j (SiO2)y (H2O)z] (5.66)
где: М - катионы, как правило щелочных и щелочноземельных металлов; j - количество катионов алюминия в ячейке; n - заряд катиона М (таким образом j/n - количество катионов М, необходимое для компенсации отрицательных зарядов алюминийсодержащих тетраэдров); Y - количество ионов кремния; Z - количество гидратационной воды.
Упрощенно структура поверхности Na-содержащего цеолита представлена на Рисунке 5.50-а. Если натрий заменить на протон, то получится цеолит в Н+-форме (Рис. 5.50-б.).
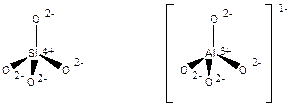
Рис. 5.49. Кремний- и алюминий-содержащие тетраэдры в структуре цеолитов.
а 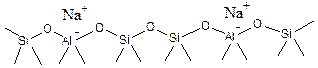
б 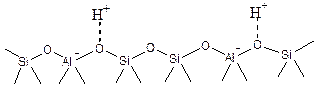
Рис. 5.50. Поверхность цеолита: а - в Na-форме; б - в Н-форме.
Регулируя при синтезе цеолитов соотношение Si/Al, природу катионов М, степень замещения М на Н+ и глубину удаления гидратационной воды кислотность цеолитом можно менять в очень широких пределах. Поэтому цеолиты являются ценными и широко применяемыми катализаторами кислотного типа в промышленной органической химии.
Благодаря уникальным свойствам применение цеолитов в катализе этим не ограничивается. Более детально цеолиты будут рассмотрены отдельно в п. ***.
Механизмы реакций, протекающих на поверхности кислотных катализаторов.
Дата добавления: 2020-07-18; просмотров: 705;











