Механизм Лэнгмюра-Хиншельвуда.
Данный механизм, был предложен в 1921 г. Он основан на следующих предположениях:
1. Оба реагента адсорбируются без диссоциации на разных активных центрах.
2. Хемосорбированные на соседних центрах реагенты взаимодействуют с образованием адсорбированного продукта С.
3. Образовавшийся продукт десорбируется.
Последовательность стадий в механизме Лэнгмюра-Хиншельвуда описывается следующими уравнениями (символ "*" относится к адсорбированному веществу):
АГ ßà А*
ВГ ßà В*
А* + В* ßà С*
С* ßà СГ
Схематично механизм изображен на Рисунке 5.5.
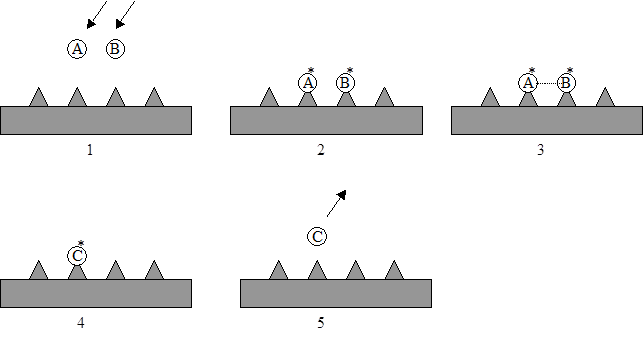
Рис. 5.5. Схема механизма Лэнгмюра-Хиншельвуда.
Любая из указанных стадий может быть лимитирующей. Рассмотрим случай лимитирования собственно химической реакции на поверхности. В этом варианте кинетическое уравнение, учитывая выражения (5.15) и (5.16) будет выглядеть так:
rЭФ = dРС/dt = kqАqВ = (kKАРАKВРВ)/(1 + KАРА + KВРВ)2 (5.21)
Можно выделить ряд частных случаев наблюдаемых кинетических закономерностей для реакций, протекающих по механизму Лэнгмюра-Хиншельвуда:
1) Когда Оба реагента слабо адсорбируются, т.е. (KА и KВ) << 1, уравнение (5.21) принимает вид: rЭФ = kKАKВPАPВ = k’PАPВ, и реакция имеет первые порядки по реагентам.
2) Когда реагент А слабо сорбируется, а В - сильно, т.е. KА << 1 << KВ, уравнение (5.21) принимает вид: rЭФ = kKАРА/(KВРВ) = k’РА/РВ, и реакция имеет первый порядок по А и минус первый по В.
Рассмотрим теперь влияние парциального давления реагента А при постоянном парциальном давлении В (рВ = const):
1) При низких РА, когда KАРА << (1 + KВРВ), уравнение (5.21) принимает вид:
rЭФ = kKАРАKВРВ/(1 + KВРВ) » k’РА,
то есть скорость реакции прямо пропорциональна РА.
2) Скорость достигнет максимума при qА = qВ, или KАРА = KВРВ.
3) При высоких РА, когда KАРА >> (1 + KВРВ), уравнение (5.21) принимает вид:
rЭФ = kKВРВ/KАРА » k’/РА,
т.е. скорость изменяется обратно пропорционально РА.
Рисунок 5.6 иллюстрирует рассмотренные три случая.
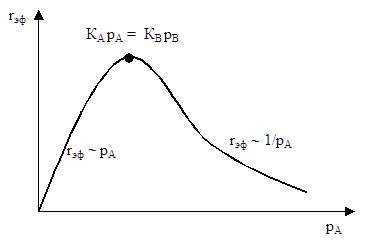
Рис. 5.6. Предельные случаи зависимости скорости бимолекулярной реакции, протекающей по механизму Лэнгмюра-Хиншельвуда, от парциального давления одного из реагентов.
Статистическое объяснение зависимости, изображенной на Рисунке 5.6, заключается в следующем: При низких давлениях А степень заполнения поверхности реагентом А (qА) низка, и все хемосорбированные молекулы А могут реагировать с хемосорбированными молекулами В. Скорость реакции растет до максимального значения (при qА = qВ). При дальнейшем росте давления А поверхность все более блокируется компонентом А и вероятность расположения хемосорбированных молекул А и В на соседних центрах уменьшается, а вследствии этого снижается скорость реакции.
Механизм Лэнгмюра-Хиншельвуда наблюдается для многих промышленных реакций. Примеры некоторых процессов приведены в таблице 5.3.
Таблица 5.3.
Примеры промышленных процессов, протекающих по механизму Лэнгмюра-Хиншельвуда.
| Процесс | Катали-затор | Уравнение реакции |
| Окисление СО | Pt | 2СО + О2 à 2СО2 |
| Синтез метанола | ZnO | СО + 2Н2 à СН3ОН |
| Гидрирование этилена | Cu | С2Н4 + Н2 à С2Н6 |
| Восстановление N2O | Pt, Au | N2O + Н2 à N2 + Н2O |
| Окисление этилена до ацетальдегида | Pd | С2Н4 + 0,5О2 à СН3СНО |
Дата добавления: 2020-07-18; просмотров: 780;











