Основные структуры хемосорбированных частиц.
Для понимания механизмов гетерогенно-каталитических реакций очень важно знать структуру хемосорбированных частиц (реагентов, промежуточных соединений и продуктов).
Существует два типа хемосорбции: молекулярная (ассоциативная) и диссоциативная. При молекулярной (ассоциативной) хемосорбции связи между атомами в адсорбируемой молекуле сохраняются. При диссоциативной хемосорбции связи в молекуле адсорбата рвутся, и образующиеся фрагменты адсорбируются на катализаторе.
Молекулярная адсорбция характерна для молекул с кратными связями и свободными парами электронов. На Рисунке (5.9 а, б, в) приведены примеры ассоциативной хемосорбции. Диссоциативная хемосорбция характерна прежде всего для молекул с одинарной связью. Углеводороды, например, метан могут адсорбироваться с последовательным отщеплением атома водорода и образованием кратных связей металл-углерод (Рис. 5.9 г). Молекулы с кратными связями также могут подвергаться диссоциативной хемосорбции (Рис.5.9 д).
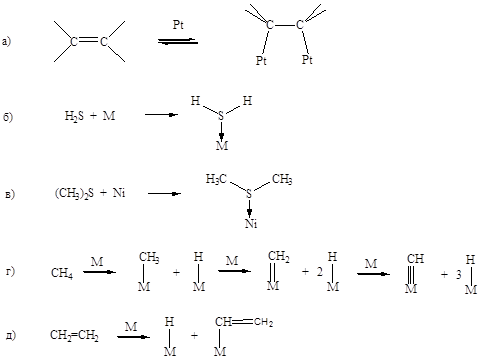
Рис.5.9. Примеры молекулярной (а, б, в) и диссоциативной (г, д) хемосорбции.
В механизме образования связей адсорбент-адсорбат много общего с металлокомплексным катализом. По типу образующихся связей поверхностные соединения делят на s- и p-комплексы. По пространственному строению поверхностные соединения делят на линейные и мостиковые. По количеству вовлеченных в хемосорбцию активных центров поверхности катализатора поверхностные комплексы делят на моно- и полиядерные. По механизму рвущейся при диссоциативной хемосорбции связи различают гомолитическую и гетеролитическую хемосорбцию.
Алкены (Рис. 5.10) адсорбируются как молекулярно (с образованием p-комплексов), так и диссоциативно (с образованием моно- и полиядерных, линейных и мостиковых соединений).
Алкены с аллильным водородом диссоциативно хемосорбируются образуя s- и p-комплексы, способные превращаться друг в друга (Рис. 5.11).
Молекула водорода диссоциативно хемосорбируется на поверхности катализаторов. Причем, на металлах диссоциация протекает гомолитически, а на оксидах гетеролитически. Атом водорода может координироваться как с одним, так и с несколькими атомами металла (Рис. 5.12).
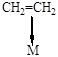
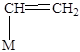

молекулярно диссоциативно молекулярно диссоциативно
моноядерный моноядерный биядерные
p-комплекс линейный мостиковые
s-комплекс s-комплексы
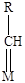
| 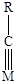
| 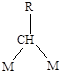
| 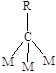
|
| диссоциативно моноядерный линейный алкилиденовый | диссоциативно моноядерный линейный алкилидиновый | диссоциативно биядерный мостиковый алкилиденовый | диссоциативно трехядерный мостиковый алкилидиновый |
Рис. 5.10. Некоторые структуры при хемосорбции алкенов.
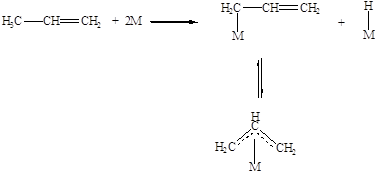
Рис. 5.11. Диссоциативная хемосорбция аллильных углеводородов с образованием моноядерных s- и p-комплексов.
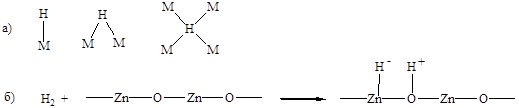
Рис. 5.12. Диссоциативная хемосорбция водорода: а) гомолитически на металлах, с образованием моно- и полиядерных центров; б) гетеролитически на оксидах металлов.
Кислород хемосорбируется как молекулярно, так и диссоциативно с образованием моно- и биядерных, линейных и мостиковых структур (Рис. 5.13).
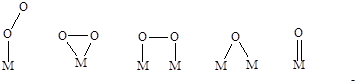
Рис. 5.13. Возможные структуры при хемосорбции кислорода.
Молекулы, проявляющие бренстедовскую кислотность (галогнводороды, карбоновые кислоты, спирты, фенолы, вода и т.п.) хемосорбируются диссоциативно по гетеролитическому механизму, и, особенно хорошо, на оксидных катализаторах:
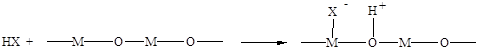 (5.23)
(5.23)
Молекула монооксида углерода, благодаря наличию неподеленной пары электронов, электронов p-связи и вакантной p*-орбитали, может образовывать разнообразные поверхностные комплексы (Рис. 5.14).
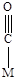
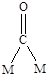
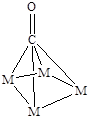
линейный мостиковый многоядерный
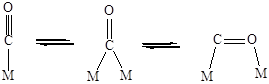
равновесие между различными поверхностными комплексами СО
Рис. 5.14. Возможные структуры при хемосорбции молекулы СО.
Для установления структуры хемосорбированных частиц используют различные физико-химические методы исследования, и одним из самых информативных из них является ИК-спектроскопия. Например, при хемосорбции молекулы СО на металлическом Pd линейный комплекс (Рис. 5.14) имеет одну характеристическую полосу поглощения 2060 см-1, а мостиковый (Рис. 5.14) две - 1960 и 1920 см-1. Характеристические частоты для поверхностных соединений СО различного строения при адсорбции на Ni приведены в Таблице 5.5. Известно, что частоты валентных колебаний в ИК-спектрах тем выше, чем стабильнее (сильнее) данная связь. То есть, сравнение величин валентных колебаний, помимо информации о строении комплекса, дает еще и информацию о степени ослабления связи в молекуле (т.е. о степени активации ее катализатором). Например, свободная молекула СО имеет nСО = 2143 см-1. Сравнивая это значение со значениями для линейного и мостикового комплекса СО на поверхности палладия (приведены выше) можно сделать вывод, что связь СО в мостиковом комплексе ослаблена гораздо сильнее, чем в линейном.
Таблице 5.5.
Полосы поглощения в ИК-спектре связи С-О молекул монооксида углерода хемосорбированных на поверхности Ni.
| Длина волны, см-1 | Интенсивность полосы | Структура комплекса |
| Сильная | 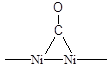
| |
| Сильная | 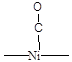
| |
| Средняя | 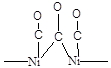
| |
| Средняя | 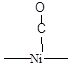
| |
| Слабая | 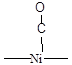
|
Дата добавления: 2020-07-18; просмотров: 659;











