Энергетический подход и каталитическая активность.
Для перехода в активированное состояние молекула реагента должна пройти стадию хемосорбции на активном центре катализатора. Сила адсорбции реагента является определяющим фактором эффективности катализа. При этом, как слишком сильная адсорбция, так и слишком слабая - не приводят к желаемой (высокой) активности катализатора. Оптимальной является некоторая средняя сила связывания адсорбата и адсорбента.
Хемосорбция и сопровождающие ее энергетические эффекты играют решающую роль в понимании гетерогенного катализа. Активные центры поверхности катализатора (свободные валентности или электронные дефекты) ослабляют химические связи в адсорбированной молекуле, в результате чего значительно облегчается ее дальнейшее химическое превращение. На Рисунке 5.16 изображено сравнение энергетических диаграмм некаталитического и гетерогенно-каталитического пути реакции А à В.

Рис. 5.16. Энергетическая диаграмма протекания газофазной реакции
Аг à Вг .
Е0 – энергия активации некаталитической реакции,
Е1 – истинная энергия активации каталитической реакции,
Е2 – кажущаяся энергия активации каталитической реакции,
Z1 – переходное состояние газофазной некаталитической реакции,
Z2 – переходное состояние реакции на поверхности катализатора,
DHR - энтальпия реакции.
Для гетерогенно-каталитических реакций (Рис. 5.16) необходимо различать кажущуюся энергию активации (Е2) - которая есть разница энергий молекулы в газовой фазе (Аг) и в переходном состоянии на активном центре (Z2), и истинную энергию активации (Е1) - которая есть разница энергий хемосорбированной молекулы (А*) и в переходном состоянии на активном центре (Z2). Последняя величина (Е1) называется еще энергией активации каталитической реакции и является наиболее важной.
Бывают случаи, когда промежуточные или конечные продукты настолько сильно адсорбированы, что не могут десорбироваться в данных условиях (слишком высок энергетический барьер стадии десорбции, соответствующий третьему максимуму пунктирной кривой на Рисунке 5.16). В этом случае говорят об отравлении катализатора продуктами реакции.
К настоящему времени накоплено большое количество экспериментальных данных по адсорбции различных веществ на разнообразных адсорбентах. В ряде случаев для понимания каталитической активности бывает достаточно простой качественной оценки относительной адсорбционной способности в рядах реагентов или катализаторов. Например, известно, что для многих металлов сохраняются следующие ряды по относительной силе адсорбции:
а) ацетиленовые > диены > алкены > алканы > полярные углеводороды > не полярные углеводороды
б) O2 > C2H2 > C2H4 > CO > H2 > CO2 > N2
Еще в 1950-х годах металлы были экспериментально классифицированы по активности к хемосорбции. В Таблице 5.6 приведены металлы, разбитые по группам от А до Д по убыванию адсорбционной активности. Как видно из таблицы, наибольшей адсорбционной активностью обладают переходные металлы (группы А-Б3), хотя есть и исключения. Как правило, хемосорбционная активность в периодах переходных металлов таблицы Менделеева проходит через максимум слева направо (группа (А) Таблицы 5.6). Эти металлы адсорбируют все газы, включая азот - наиболее трудно хемосорбируемое вещество. Металлы, представленные в группе (Д) способны хемосорбировать только кислород - наиболее активный газ. С точки зрения электронного строения металлы группа (А) являются переходными и принадлежат 4-8 группе периодической таблицы. Металлы группы (Б1) являются неблагородными металлами 9-10 групп, металлы группы (Б2) - благородные металлы этих групп. В группу (Б3) входят Mn и Cu - металлы первого переходного периода с аномальным поведением. Металлы остальных групп расположены в периодической таблице левее и правее перечисленных выше.
Таблице 5.6.
Классификация металлов по их хемосорбционным свойствам.
(+ сильная хемосорбция; ± слабая хемосорбция; - нет хемосорбции)
| Символ группы | Металлы | Газы | ||||||
| O2 | C2H2 | C2H4 | CO | H2 | CO2 | N2 | ||
| А | Ti, Zr, Hf, V, Nb, Ta, Cr, Mo, W, Fe, Ru, Os | + | + | + | + | + | + | + |
| Б1 | Ni, Co | + | + | + | + | + | + | - |
| Б2 | Rh, Pd, Pt, Ir | + | + | + | + | + | - | - |
| Б3 | Mn, Cu | + | + | + | + | ± | - | - |
| В | Al, Au | + | + | + | + | - | - | - |
| Г | Li, Na, K | + | + | - | - | - | - | - |
| Д | Mg, Ag, Zn, Cd, In, Si, Ge, Sn, Pb, As, Sb, Bi | + | - | - | - | - | - | - |
Электронное строение металлов является определяющим фактором их каталитической активности. Переходные металлы с частично заполненными d-орбиталями являются наиболее активными катализаторами. Металлы, имеющие только неспаренные S- и Р-электроны обладают низкой хемосорбционной и, следовательно, каталитической активностью.
Силу адсорбции можно оценивать по различным критериям:
- по коэффициенту (константе) адсорбции;
- по константе равновесия обмена одного адсорбированного вещества на другое;
- по величине теплового эффекта адсорбции.
С позиции термодинамики адсорбция является экзотермическим процессом (DH < 0), при котором образуются новые связи между атомами адсорбата и атомами поверхности адсорбента. При переходе из газовой фазы в адсорбированное состояние степень свободы молекулы уменьшается, то есть изменение энтропии процесса DS всегда отрицательно.
Адсорбция протекает, если изменение энергии Гиббса в этом процессе меньше нуля:
DG = DH - TDS (5.24)
Можно предположить, что значения DS не сильно различаются в зависимости от реагентов и адсорбентов. Таким образом, решающим фактором становится величина энтальпии адсорбции (DH), которая определяется, в первом приближении, силой химической связи между адсорбатом и адсорбентом.
Рассмотрим энергетическую диаграмму (Рис. 5.17), на которой изображены две кривые, физической (1) и химической (2) адсорбции водорода на металлическом никеле, отражающие изменение потенциала системы в зависимости от межатомного расстояния Ni-H.








Рис. 5.17. Изменение потенциальной энергии в зависимости от межатомного расстояния Ni-H при адсорбции водорода на никеле.
Кривая 1 – физадсорбция (0,32 нм, DHФ = -4 кДж/моль),
Кривая 2 – хемосорбция (0,16 нм, DHХ = - 46 кДж/моль),
EД - энергия диссоциации H2 (218 кДж/моль),
EA – энергия активации адсорбции.
Более пологая кривая 1 соответствует процессу физадсорбции молекулы Н2. Кривая 2 соответствует процессу хемосорбции атомарного водорода - продукта гомолитической диссоциации молекулы водорода..
Реальная диаграмма процесса диссоциативной хемосорбции молекулы водорода на поверхности Ni имеет суммарный вид с максимумом в точке пересечения этих двух кривых (А). Приближаясь к поверхности Ni молекула Н2 сначала физически адсорбируется с низким тепловым эффектом DHФ. В точке (А) начинается процесс диссоциации связи Н-Н и образование связей Ni-Н. Потенциальный барьер ЕА соответствует наблюдаемой энергии активации хемосорбции. Хемосорбированный водород имеет наименьшую потенциальную энергию и наименьшее расстояние до каталитической поверхности (точка (В)). Схематично стадии хемосорбции водорода на поверхности никеля изображены на Рисунке 5.18.
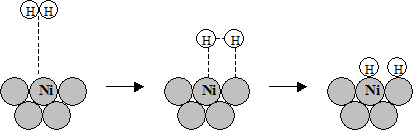
Физадсорбция Переходное Хемосорбция
состояние
Рис. 5.18. Схема механизма диссоциативной адсорбции Н2 на поверхности Ni.
Для процесса хемосорбции:
0,5Н2(Г) + Ni à H-Ni (5.25)
экспериментально определенные термодинамические характеристики составляют: DH = -46 кДж/моль, DS = -68 Дж/моль. Таким образом при 300К:
DG = -46 + (300×0,068) = -25,6 кДж/моль (5.26)
Это означает, что вероятность протекания данного процесса весьма высока.
Поскольку гетерогеннокаталитические реакции всегда протекают через стадию хемосорбции хотя бы одного из реагентов, то, очевидно, что каталитическая активность зависит от прочности связи (или энергии связи) в образующемся поверхностном комплексе. Энергию связи экспериментально можно оценить по значениям теплоты хемосорбции вещества на поверхности. Установлено, что теплота адсорбции снижается с увеличением степени заполнения поверхности адсорбатом, поэтому прочность связи оценивают по значениям начальных теплот адсорбции (т.е. при низких степенях заполнения).
Установлено, что теплоты адсорбции (а следовательно, и прочность связи в поверхностных соединениях) монотонно снижаются в рядах переходных металлов периодической таблицы слева направо.
Оказалось, что начальные теплоты адсорбции газов на металлах изменяются симбатно теплотам образования соответствующих гомогенных соединений из данного металла и адсорбата. Результатом этого являются линейные корреляции теплот адсорбции и теплот образования соответствующих гомогенных соединений. На Рисунке 5.19 верхняя прямая отображает линейную зависимость начальной теплоты адсорбции О2 на металлах в зависимости от теплот образования высшего оксида металла в пересчете на 1 г-атом металла. При этом для многих газов наблюдаются линейные корреляции начальных теплот адсорбции с теплотой образования высшего оксида металла (Рис. 5.19).
Из этого следует два важных вывода:
1) Об относительной прочности связи в поверхностном комплексе адсорбат-металл можно судить по значениям теплот образования гомогенных соединений адсорбата с металлом или по значениям теплот образования высшего оксида данного металла.
2) Природа связи в поверхностном комплексе во многом близка природе связи в соответствующем гомогенном соединении.
Последний вывод находит экспериментальное подтверждение в близости значений полос поглощения ИК-спектров хемосорбированных молекул на поверхности металлов и соответствующих им индивидуальных гомогенных комплексов. Так, например, валентные колебания С-Н связи в молекуле этилена, хемосорбированной на поверхности нанесенного катализатора Pd/SiO2 и в гомогенном p-комплексе Pd(С2Н4) имеют частоты 2980 и 2952 см-1, соответственно, а валентные колебания С=С связи - 1510 и 1502 см-1.
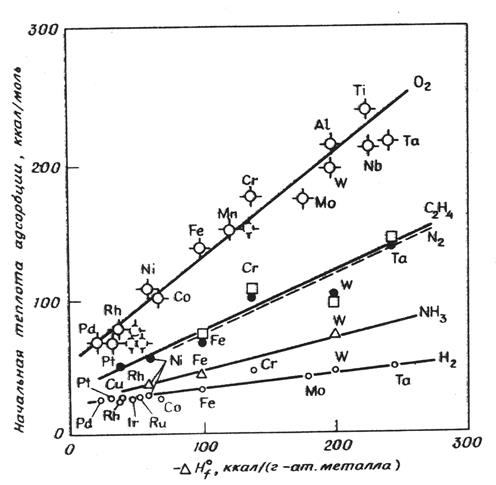
Рис. 5.19. Линейная корреляция между начальной теплотой адсорбции O2, N2, C2H4, NH3, H2 на соответствующем металле и теплотой образования высшего оксида данного металла в расчете на 1 г-атом металла.
Классическим примером, демонстрирующим влияние энергии связи в поверхностном соединении на каталитическую активность металлов, является реакция гетерогеннокаталитического разложения муравьиной кислоты. ИК-спектры адсорбированной молекулы муравьиной кислоты идентичны спектрам индивидуальных формиатов соответствующих металлов, что говорит о том, что механизм катализа включает стадию образования поверхностного формиат-аниона, которая протекает по диссоциативному механизму (Рис. 5.20).
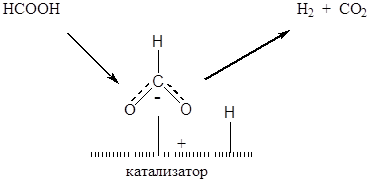
Рис. 5.20. Схема механизма гетерогеннокаталитического разложения муравьиной кислоты.
На Рисунке 5.21 изображена диаграмма относительной активности металлов в данной реакции от энтальпии образования формиата соответствующего металла. За меру каталитической активности металлов выбрана температура при которой скорость реакции достигает одного и того же значения. Чем ниже эта температура, тем активнее катализатор. Зависимость имеет экстремальный характер - так называемый вулканоподобный график. Такому виду зависимости можно дать следующее объяснение. Энтальпия образования формиата характеризует прочность связи поверхностного комплекса. Таким образом, слева от максимума расположены металлы относительно слабо хемосорбирующие муравьиную кислоту (Au, Ag); справа - образующие прочную связь (Ni, Co, Fe, W). И те, и другие являются слабыми катализаторами данной реакции. Для первых сила связывания слишком слаба, что бы в достаточной степени дестабилизировать молекулу муравьиной кислоты, а для вторых сила связывания настолько высока, что получающийся поверхностный комплекс очень устойчив и трудно подвергается дальнейшим превращениям.
Наиболее эффективными катализаторами являются металлы со средней теплотой образования формиатов (Pd, Pt, Ir, Ru, Rh), т.е. со средней силой связи в поверхностном комплексе. В данном случае имеет место оптимальное соотношение степени ослабления связи в адсорбированной молекуле муравьиной кислоты и устойчивости образующегося поверхностного соединения.
Аналогичные вулканоподобные корреляции активности катализаторов могут быть получены и с другими термодинамическими характеристиками, например с энальпиями адсорбции или десорбции.

Рис. 5.21. Относительная каталитическая активность металлов в реакции разложения муравьиной кислоты, как функция энтальпии образования индивидуальных формиатов металлов (вулканоподобный график).
Как уже отмечалось гетерогенно-каталитическая реакция протекает через последовательность стадий хемосорбции, химической реакции на поверхности и десорбции. В зависимости от соотношения энергетических барьеров (энергий активации) каждой из стадий, любая из них может являться лимитирующей и определять скорость реакции в целом, т.е. характеризовать каталитическую активность.
Показательным примером является зависимость активности первого ряда переходных металлов от энтальпии адсорбции на них азота и аммиака в промышленно важной реакции синтеза аммиака (Рис. 5.22).
Левая часть графика отражает корреляцию каталитической активности с энтальпией адсорбции азота, правая – с энтальпией адсорбции аммиака. Металлы слева от максимума связывают азот слишком сильно, образуя устойчивые поверхностные соединения (по природе своей близкие к нитридам металлов), которые мало активны в дальнейшем химическом превращении (энергия активации химической реакции слишком высока). Металлы справа от максимума - слишком прочно адсорбируют образующийся аммиак, т.е. энергия активации десорбции аммиака слишком высока. Это приводит к высокой степени покрытия поверхности аммиаком и, следовательно, к низкой скорости реакции. Оптимальная сила связывания наблюдается на Fe - классическом катализаторе синтеза аммиака.

Рис. 5.22. Вулканоподобный график каталитической активности металлов в реакции синтеза аммиака.
В Таблице 5.7 приведены примеры зависимости каталитической активности металлов от положения элемента в рядах переходных металлов (т.е. от электронного строения). Как видно, зависимости имеют вулканообразный характер. Наиболее активны металлы, имеющие 6-8 d-электронов.
Рассмотренные выше примеры показывают, что общая тенденция в рядах переходных металлов состоит в ослаблении силы связывания реагента с поверхностью катализатора слева направо. В начале рядов связь настолько прочна, что не может быть разорвана. В конце ряда, напротив, она настолько слаба, что концентрация связанного реагента на поверхности крайне мала и, как следствие, скорость реакции также очень низка. Металлы, расположенные в середине рядов, проявляют оптимальную силу связывания реагента, при которой поверхностная концентрация реагента достаточно высока и молекулы реагента активированы на столько, что бы обеспечивалась высокая скорость превращения (низкая энергия активации).
Таблица 5.7.
Относительная скорость реакции при катализе переходными металлами и их соединениями.
| Ряд | Реакция (катализатор) | Металлы и относительная скорость реакции | ||||||
| Гидрирование этилена (металл) | Cr 0,95 | Fe | Co | Ni | Cu 1,2 | |||
| Гидродесульфуризация дибензотиофена (сульфид металла) | Nb 0,5 | Mo | Nc | Ru | Rh | Pd | ||
| Гидрогенолиз CH3NH2 до метана и аммиака (металл) | Re 0,008 | Os 0,9 | Ir | Pt | Au 0,5 |
Дата добавления: 2020-07-18; просмотров: 651;











