Материальный баланс электрохимических реакций.
Законы Фарадея
Законы Фарадея – это частный случай применения закона эквивалентов к электрохимическими реакциям, в которых одним из «реагентом» оказываются электроны. В общем виде этот закон можно описать следующим уравнением:
 =
= 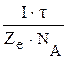 (14.1)
(14.1)
Х – вещество, окисленное или восстановленное при электролизе;
m(X) – масса этого вещества в граммах;
M(X) – молярная масса этого вещества;
fэкв – фактор эквивалентности вещества (определяется по уравнению
реакции);
I – сила тока (в Амперах или Кулон/с);
Ze – заряд электрона (1,6·10–19 Кулон);
NA – число Авогадро (6,02·1023 моль–1);
τ – время электролиза (в секундах).
Таким образом, закон эквивалентов применительно к электрохимическим реакциям можно сформулировать следующим образом:
Сколько моль электронов участвовало в реакции, столько же моль
эквивалента вещества окислится на аноде и восстановится на катоде.
В числителе правой части уравнения (14.1) произведение I·τ – это величина заряда (в Кулонах), пропущенного через электролит, а в знаменателе Ze·NA – это заряд одного моля электронов: 1,6·10–19·6,02·1023 = 96484  96500 Кл/моль – число Фарадея.
96500 Кл/моль – число Фарадея.
Если в реакции восстанавливаются (окисляются) металлы, то уравнение (14.1) преобразуется в следующее:
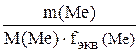 =
= 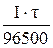 (14.2)
(14.2)
Если в реакции окисляются или восстанавливаются газообразные вещества, то получим уравнение
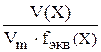 =
=  (14.3)
(14.3)
V(X) – объем газа, л,
Vm – молярный объем
Дата добавления: 2020-07-18; просмотров: 503;











