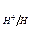Электрохимические реакции.
Механизм образования двойного электрического слоя; понятие об электродном потенциале.
Известно, что при контакте с водой металлы, в зависимости от их природы, ведут себя по-разному. Щелочные и щелочноземельные металлы «растворяются» в воде (окисляются ею, образуя растворимые гидроксиды). Магний, алюминий и др. окисляются водой, но только в тонком поверхностном слое (т.к. их гидроксиды в воде малорастворимы). И, наконец, большая часть металлов с жидкой водой «практически не взаимодействуют». Однако даже металлы, относящиеся к «благородным», не абсолютно инертны в контакте с водой. Например, давно известны бактерицидные свойства «святой воды», обусловленные переходом в воду ионов из металлического серебра. Каков механизм появления этих ионов в растворе?
Металлы – это твердые (кроме ртути) вещества, в узлах кристаллической решетки которых находятся катионы, связанные друг с другом делокализованными валентными электронами (металлической связью). При контакте металла с водой в результате ион-дипольного взаимодействия катионов металла (Men+) с молекулами (диполями) воды часть их перейдет в раствор в виде гидратов (Men+ ·yH2O), а на металле появится избыток электронов (металл «поляризуется катодно»).
Таким образом, на границе металл/раствор образуется двойной электрический слой: отрицательно заряженная поверхность металла/слой катионов металла в растворе, что можно представить следующей схемой:
xMe + yН2О « [(x-z)Me + z×n·е] + zMen+ ·yH2O.
металлич. металлич. катионы металла
пластина пластина в растворе

В результате образования двойного электрического
слоя на границе металл-раствор образуется своего
рода «конденсатор» и возникает скачок потенциа-
ла, который называют электродным потенциалом
и обозначают φ.
 Величина электродного потенциала зависит от многих факторов, влияние которых можно выявить, рассмотрев всю последовательность превращений металла при переходе его из простого вещества в раствор. Очевидно, что такой переход включает следующие изменения энергии:
Величина электродного потенциала зависит от многих факторов, влияние которых можно выявить, рассмотрев всю последовательность превращений металла при переходе его из простого вещества в раствор. Очевидно, что такой переход включает следующие изменения энергии:

 – затраты ее на разрыв химических связей между атомами в решетке металла (Ереш),
– затраты ее на разрыв химических связей между атомами в решетке металла (Ереш),
– расход энергии на ионизацию атомов с превращением их в катионы (характеризуется потенциалом ионизации, I),
– выделение энергии при связывании катионов металла с молекулами воды (энергия гидратации, Егидр.).
Чем меньше энергия металлической решетки и потенциал ионизации атомов металла и чем больше энергия гидратации (сольватации) катионов металла, тем более энергетически выгодным будет переход ионов металла в раствор, тем большим по абсолютной величине будет электродный потенциал. Если учесть, что на величину потенциала влияют также пространственное распределение ионов металла в растворе, изменение структуры растворителя и т. д., то станет ясно, что рассчитать абсолютную величину электродного потенциала не представляется возможным.
С другой стороны, экспериментальное определение абсолютной величины электродного потенциала также невозможно вследствие того, что хотя двойной электрический слой и представляет собой своеобразный «конденсатор», подключить к нему измерительную систему не удастся, т.к. одна из «обкладок» такого конденсатора – это катионы металла в растворе.
Вследствие изложенных выше причин остается только один вариант – определять не абсолютную, а относительную величину электродного потенциала или разность электродных потенциалов двух систем (полуэлементов), соединенных электрической цепью.
На приведенном ниже рисунке показан вариант такой системы, включающей цинковый и медный полуэлементы.
|

Рис.1 Схема медно-цинкового
гальванического элемента
Вследствие того, что металлический цинк окисляется легче, чем медь, его потенциал – более отрицательный, чем для меди. В таком случае цинк «поляризован анодно», а медь «поляризована катодно». Следовательно, на рисунке 1 цинковый электрод – это анод, а медный – катод.
Условия, необходимые для работы гальванического элемента:
Если в схеме, приведенной выше, единственным электролитом является вода, то такой гальванический элемент работать не будет, и разность электродных потенциалов измерить не удастся. Для работы гальванического элемента необходимо выполнение следующих условий:
– металлы полуэлементов должны быть погружены в растворы их солей;
– металлы полуэлементов должны иметь электрический контакт друг с другом (соединяться внешней цепью);
– должен быть электрический контакт растворов полуэлементов для обеспечения противотока ионов (наличие внутренней цепи).
При обеспечении этих условий элемент будет работать до выравнивания потенциалов полуэлементов.
Разность электродных потенциалов двух полуэлементов, например цинкового и медного ( 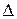 φ) – это разность потенциалов катодного и анодного процессов:
φ) – это разность потенциалов катодного и анодного процессов:
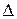 φ = E = φкатода – φ анода = φ
φ = E = φкатода – φ анода = φ 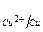 – φ
– φ 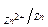 ,
,
где  φ = Е называют электродвижущей силой (ЭДС) гальванического элемента.
φ = Е называют электродвижущей силой (ЭДС) гальванического элемента.
Вследствие того, что на практике используют не абсолютные, а относительные величины потенциалов, возникла необходимость определять их относительно одной и той же системы сравнения. В качестве электрода (полуэлемента) сравнения был выбран «водородный электрод». Устройство этого электрода показано на рис. 2.
|
 |
Факторы, влияющие на величину электродного потенциала;
уравнение Нернста; стандартный электродный потенциал.
Стандартный электродный потенциал (φ0) окислительно-восстановительной системы – это потенциал, измеренный в стандартных условиях: при T=298 K и молярности (активности) веществ, участвующих в превращении, равной 1 моль/л. Электродный потенциал измеряется в Вольтах (В). Для водородного электрода стандартный потенциал условно приняли за «ноль».
Если условия нестандартные, то величину электродного потенциала рассчитывают по уравнению Нернста. Уравнение Нернста показывает зависимость электродного потенциала от природы веществ, участвующих в равновесии (через φ0), их концентрации и температуры:
φ = φ0 + 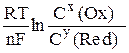 (13.1)
(13.1)
R — универсальная газовая постоянная (8,31 Дж/моль·К),
T — температура в градусах Кельвина,
F — число Фарадея (заряд электронов количеством 1 моль, 96500 Кулон/моль),
n —число электронов, участвующих в элементарной реакции
С(Ox) и С(Red) – молярные концентрации окисленной (oxidation) и восстановленной (redaction) форм веществ, составляющий полуэлемент; x, y – соответствующие им стехиометрические коэффициенты в уравнении реакции.
При подстановке в уравнение (13.1) Т = 298 К, F = 96500 Кулон/моль и замене ln ® lg для гомогенной окислительно-восстановительной системы
xOx + ne « yRed
получим следующее уравнение
φ = φ0 + 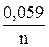
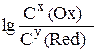 (13.2)
(13.2)
Если в равновесии участвуют газообразные вещества, то молярные их концентрации можно заменить на парциальные давления. Твердые вещества (например, металлы) в уравнение Нернста не включают.
Величина электродного потенциала – это количественная характеристика окислительно-восстановительных свойств веществ:
Чем больше алгебраическая величина электродного потенциала, тем большими окислительными свойствами обладает окисленная форма и тем меньшими восстановительными – восстановленная форма вещества.
Уравнение Нернста для водородного электрода: 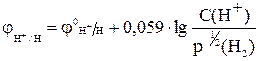 ,
,
При нормальном давлении (p = 1 атм.) это уравнение преобразуется
в следующее: 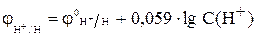
Учитывая, что стандартный потенциал водородного электрода 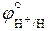 приняли равным нулю, а также то, что –lgC(H+) = pH, получим зависимость водородного электрода от pH:
приняли равным нулю, а также то, что –lgC(H+) = pH, получим зависимость водородного электрода от pH:
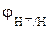 =– 0,059 pH
=– 0,059 pH (13.3)
(13.3)
При pH = 7: 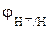 = – 0,059 pH
= – 0,059 pH  = – 0,059·7 = – 0,41 B
= – 0,059·7 = – 0,41 B
Дата добавления: 2020-07-18; просмотров: 554;