Химические источники электрической энергии (ХИЭЭ)
Все ХИЭЭ подразделяются на источники однократного действия –-«элементы» – и многократного действия – «аккумуляторы».
Разработано довольно много вариантов элементов; из них наиболее распространенными являются маргацево-цинковые элементы, схема устройства которых показана на рис. 4.

Рис. 4. Схема марганцево-цинкового элемента:
1 – анод (корпус, изготовленный из цинка);
2 – катод (диоксид марганца в смеси с графитовым
порошком, для увеличения электропроводности);
3 – токоотвод из графита;
4 – электролит (паста из хлорида аммония в смеси с
загустителем (крахмал или др.).
Анод (–): Zn = Zn2+ + 2e–, далее: Zn2+ + 4NH4+ = [Zn(NH3)4]2+ + 4H+
Катод (+): MnO2 + H+ + e– = MnO(OH)
_________________________________________
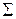 : 2Zn + 4MnO2 + 4NH4Cl = [Zn(NH3)4]Cl2 +ZnCl2 + 4MnO(OH)
: 2Zn + 4MnO2 + 4NH4Cl = [Zn(NH3)4]Cl2 +ZnCl2 + 4MnO(OH)
Аккумуляторы.
Аккумуляторами называют устройства, позволяющие многократное повторение операций их зарядки–разрядки. В принципе регенерировать можно любое электрохимическое устройство, но при этом восстановленная емкость обычно невелика. В аккумуляторах эти операции можно повторять многократно.
Наиболее распространены кислотные свинцовые, щелочные никель–кадмиевые и серебряно–цинковые аккумуляторы.
Свинцовый аккумулятор.
Электроды свинцового аккумулятора выполнены в виде ячеистых пластин из свинцового сплава; ячейки заполнены смесью свинцового глета (PbO) с глицерином. После заполнения аккумулятора электролитом (H2SO4) оксид свинца превращается в сульфат.
Зарядка аккумулятора (преобразование электрической энергии в энергию химической реакции): При подключении электродов к внешнему источнику постоянного тока одни из них поляризуются катодно (–), и на нем протекает реакция восстановления свинца(II), другой — анодно (+), и на нем свинец(II) окисляется:
Катод (–): PbSO4 + 2e = Pb + SO42-
Анод (+): PbSO4 + 2H2O = PbO2 + SO42- + 4H+ + 2e
______________________________________________________________________
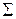 : 2PbSO4 + 2H2O = Pb + PbO2 + 2H2SO4
: 2PbSO4 + 2H2O = Pb + PbO2 + 2H2SO4
ЭДС заряженного аккумулятора – около 2 В. Из суммарного уравнения реакции видно, что одним из продуктов реакции является серная кислота, поэтому при зарядке аккумулятора концентрация электролита увеличивается (по изменению плотности электролита контролируют степень заряженности аккумулятора).
Разрядка аккумулятора – превращение энергии окислительно-восстановительной реакции в электрическую энергию. При замыкании внешней цепи электроны с анода (Pb) переходят на электроды, заполненые PbO2 (катод):
Катод (–): PbO2 + SO42– + 4H+ + 2e = PbSO4 + 2H2O
Анод (+): Pb + SO42- = PbSO4 + 2e
_______________________________________________
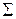 : Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
: Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O
Из полученного уравнения видно, что при разрядке аккумулятора плотность электролита уменьшается (на этом основан один из простых методов контроля заряда аккумулятора).
К основным преимуществам свинцового аккумулятора относятся большая электрическая емкость (А-час/кг) и устойчивость в работе при многократных циклах перезарядки. Основные недостатки – массивность и негерметичность.
Кадмиево-никелевый аккумулятор. Схема его работы может быть показана следующими превращениями:
разряд ®
2NiO(OH) + Cd 2Ni(OH)2 + Cd(OH)2, ЭДС = 1,4 В
заряд
Серебряно-цинковый (СЦ) аккумулятор
Вследствие большой удельной емкости и большой ЭДС эти аккумуляторы чаще всего применяются для питания различных микроэлектронных устройств. Их работа основана на следующих окислительно-восстановительных реакциях:
разряд ®
AgO + Zn + H2O Ag + Zn(OH)2
заряд
Применение электролиза
Электрохимическое получение металлов (алюминий, щелочные и щелочноземельные металлы и др.); рафинирование (очистка) металлов; гальванопластика и гальваностегия; электрохимическая обработка поверхностей металлов и др.
Химические источники электрической энергии
Устройства непрерывного действия, в которых энергия химического окисления топлива непосредственно превращается в электрическую энергию, называют химическими источниками электрического тока или топливными элементами.
 В качестве восстановителя (топлива) в таких элементах используют водород, окись углерода, метан и др. органические вещества, а в качестве окислителя, чаще всего, – чистый кислород, иногда воздух. В настоящее время наиболее изучен водородно-кислородный топливный элемент, схема которого показана на рис 5.
В качестве восстановителя (топлива) в таких элементах используют водород, окись углерода, метан и др. органические вещества, а в качестве окислителя, чаще всего, – чистый кислород, иногда воздух. В настоящее время наиболее изучен водородно-кислородный топливный элемент, схема которого показана на рис 5.
Рис. 5. Схема водородно-кислородного топливного элемента:
1 – анод; 2 – электролит; 3 – катод
Катод и анод такого элемента изготовлены из пористого графита и катализатора – металла платиновой группы. На катоде восстанавливается кислород, а водород окисляется на аноде. В зависимости от выбранного электролита (щелочи или кислоты) электрохимические реакции можно описать следующими уравнениями:
В щелочной среде (электролит – гидроксид калия):
Анод: 2H2 + 4OH– = 4H2O + 4e
Катод: O2 + 2H2O + 2e = 4OH–
_____________________________________________
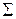 : 2H2 + O2 = 2H2O
: 2H2 + O2 = 2H2O
В кислой среде (электролит – фосфорная кислота):
Анод: 2H2 = 4H+ + 4e
Катод: O2 + 4H+ + 4e = 2H2O
_______________________________________________
 : 2H2 + O2 = 2H2O
: 2H2 + O2 = 2H2O
ЭДС такого элемента не зависит от pH:

Дата добавления: 2020-07-18; просмотров: 502;











