Электрохимический ряд металлов
В соответствии с увеличением окислительных свойств катионов металлов (окисленная форма) и уменьшением восстановительных свойств металлов – простых веществ (восстановленная форма) построен известный
электрохимический ряд металлов:
Li K Na Mg Al Ti Mn Zn Fe Pb H Bi Cu Ag Pt Au
В электрохимическом ряду левее водорода расположены металлы, стандартные электродные потенциалы которых отрицательнее, чем у водородного электрода; правее водорода расположены металлы, стандартные электродные потенциалы которых положительные.
Для того, чтобы экспериментально определить стандартный электродный потенциал какого-нибудь металла, например цинка, необходимо в стандартных условиях собрать гальванический элемент, в котором один электрод будет металлическим (цинковым), а другой – водородным и измерить разность потенциалов такого элемента, Е0:
Zn ÷ ZnCl2 ÷÷ HCl ÷ H2 (Pt) 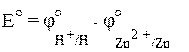
Для цинка стандартный электродный потенциал отрицательнее водородного на 0,77 В, т.е 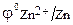 = – 0,77 B
= – 0,77 B
Примечание: Вследствие того, что практически измерима только разность потенциалов (относительно водородного электрода, Е0 = 0) запись 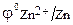 = – 0,77 B
= – 0,77 B
не совсем корректна. Однако, в литературе иногда отождествляют обозначения φ0 и Е0 (в последнем случае ЭДС обозначают как  Е0).
Е0).
Стандартные электродные потенциалы различных окислительно-восстановительных систем приводятся в справочниках.
Пример 1. Рассчитать ЭДС цинк-серебряного гальванического
элемента в стандартных условиях.
Решение: В стандартных условиях
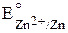 = – 0,77 В,
= – 0,77 В, 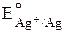
 = 0,80 В
= 0,80 В
тогда ЭДС такого элемента
E0= E0катода– E0анода = 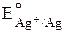 –
– 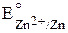 = 0,80 – (– 0,77) = 1,57 В
= 0,80 – (– 0,77) = 1,57 В 
В заключение отметим, что согласно уравнению Нернста (см. уравнение 4), разность потенциалов двух полуэлементов может возникнуть даже в тех случаях, когда они образованы одинаковыми металлами, но при этом различаются концентрации растворов электролитов или их температура.
Выбор окислителя (восстановителя) с помощью таблиц электродных потенциалов. Определение преимущественного направления окислительно-восстановительных реакций
Таблица электродных потенциалов позволяет определить возможность окислительно-восстановительной реакции не только между металлами и их катионами, но и между любыми потенциальными окислителями и восстановителями. Окислителем будет вещество, восстановлению которого соответствует больший электродный потенциал.
Согласно химической термодинамике самопроизвольно протекают реакции, в результате которых уменьшается энергия Гиббса (DG х.р. < 0).
Для окислительно–восстановительных реакций DG0 х.р.= – nFDE0, где DЕ0 – разность стандартных электродных потенциалов окислительной и восстановительной систем (DE0 = E0ок. – E0 восст.), F – число Фарадея (96500 Кулон/моль), n — число электронов, участвующих в элементарной реакции; DE часто называют ЭДС реакции. Очевидно, что DG0х.р.< 0, если DE0х.р.>0.
Как рассчитать ЭДС реакции?
Любую окислительно–восстановительную реакцию, например
Sn4+ + Fe2+ « Sn2+ + Fe3+
можно представить как сочетание двух полуреакций:
Sn4+ « Sn2+ и Fe2+ « Fe3+;
В каком направлении реакция может протекать самопроизвольно, в прямом или в обратном? Или, другими словами, что реально осуществить: окислить Fe2+ ионами Sn4+ или окислить Sn2+ ионами Fe3+?
Каждая из этих полуреакций характеризуется величиной электродного потенциала (справочные данные):
E0Sn4+/Sn2+ = + 0,15 В, E0Fe3+/Fe2+ = + 0,77 В,
Если протекает прямая реакция, то система Sn4+ « Sn2+ будет окислительной, а система Fe2+ « Fe3+ – восстановительной:
Sn4+ + Fe2+ ® Sn2+ + Fe3+
ок-ль в-ль
Тогда ЭДС (DE0) этой реакции
DE0 =E0ок..– E0восст.= E0Sn4+/Sn2+ – E0Fe3+/Fe2+ = 0,15 – 0,77 = – 0,62 В.
Таким образом, для прямой реакции DE0 < 0, и поэтому она самопроизвольно протекать не будет, может протекать обратная реакция. Или, другими словами, в стандартных условиях невозможно окислить Fe2+ ионами Sn4+, а окислить Sn2+ ионами Fe3+ можно.
Окислительно–восстановительная реакция протекает в направлении, для которого электродный потенциал окислительной системы больше электродного потенциала восстановительной системы.
С помощью этого критерия можно также выбрать окислитель (или восстановитель) для заданного вещества.
Пример 1. Можно ли окислить иодид калия хлоридом железа(III)?
Решение:
а) напишем схему предполагаемой реакции:
I– + Fe3+ ® I2 + Fe2+,
в–ль о–ль
б) напишем полуреакции для окислительной и восстановительной систем и соответствующие им электродные потенциалы:
Fe3+ + 2e ® Fe2+ E0 = + 0,77 B – окислительная система,
2I– ® I2 + 2e E0 = + 0,54 B – восстановительная система;
в) сравнив потенциалы этих систем, сделаем вывод, что заданная реакция возможна (в стандартных условиях).
Пример 2. Подобрать окислители (не менее трёх) для заданного превращения вещества и выбрать из них тот, при котором реакция протекает наиболее полно: Cr(OH)3 ® CrO42–.
Решение:
а) по справочным данным E0CrO42–/Cr(OH)3 = – 0,13 В.
б) выберем с помощью справочника подходящие окислители (их потенциалы должны быть большими, чем – 0,13 В), при этом ориентируемся на наиболее типичные, «недефицитные» окислители (например, галогены – простые вещества, перекись водорода, перманганат калия и т.п.).
При этом окажется, что если превращению Br2 ® 2Br– соответствует один потенциал E0 = +1,1 В, то для перманганат–ионов и перекиси водорода возможны варианты, в зависимости от кислотности среды:
E0MnO4– /Mn2+ = + 1,51 B – в кислой
E0MnO4– /MnO2 = + 0,60 B – в нейтральной
E0MnO4– /MnO42– = + 0,56 B – в щелочной
E0H2O2 /H2O = + 1,77 B – в кислой
E0H2O2/OH– = + 0,88 B – в щелочной
Учитывая, что гидроксид хрома – амфотерный и поэтому существует только в слабощелочной или нейтральной среде, из выбранных окислителей подойдут:
E0MnO4– /MnO2 = + 0,60 B и E0Br2 /Br– = + 1,1 B..
в) последнее условие, выбор оптимального окислителя из нескольких, решается на основании того, что реакция протекает тем полнее, чем отрицательнее для неё DG0, что в свою очередь определяется величиной DE0:
Чем больше алгебраически величина DE0х.р., тем более полно протекает окислительно–восстановительная реакция, тем больше выход продуктов.
В результате из рассмотренных выше окислителей DE0 будет наибольшей для брома (Br2):
E0х.р = E0ок. – E0 восст = E0Br2 /Br– – E0CrO42–/Cr(OH)3 = 1,1 – (– 0,13) = 1,23 В.
Реакции диспропорционирования
Реакции диспропорционирования (или самоокисления–самовосстановления) отличаются тем, что в них степень окисления меняют атомы одного и того же элемента: часть их окисляется, отдавая электроны, а другая часть — восстанавливается, присоединяя эти электроны.
Очевидно, что такая возможность имеется только для атомов элементов, имеющих промежуточную степень окисления, например:
– 0 +
а) Cl Cl ® Cl
или в ионно–молекулярной форме:
Cl– Cl2 ® HClO – в кислой и нейтральной среде,
Cl– Cl2 ® ClO– – в щелочной среде
+4 +6 +7
б) Mn Mn ® Mn
или в ионно–молекулярной форме:
MnO2 MnO42– ® MnO4– – в нейтральной среде,
Mn2+ MnO42– ® MnO4– – в кислой среде.
Как и для других окислительно–восстановительных реакций, при диспропорционировании должно выполняться условие: реакция преимущественно протекает в направлении, для которого ЭДС >0
Проверим выполнение этого условия для приведенных примеров.
а) нейтральная среда: Cl2 + 2e « 2Cl– Е0ок = +1,35 B
Cl2 + 2H2O « 2HClO + 2H+ + 2e Е0восст= +1,63 B
ЭДС = Е0ок – Е0восст = 1,35 –1,63 = – 0,28 B;
щелочная среда:
Cl2 + 2e « 2Cl– Е0ок = +1,35 B
Cl2 + 4OH– « 2ClO– + 2H2O + 2e Е0восст= +0,40 B
ЭДС = Е0ок – Е0восст = 1,35 – 0,40 = + 0,95 B
Из полученных данных следует, что хлор – простое вещество в водных растворах в нейтральной и, особенно в кислой среде, существует преимущественно в виде молекул Cl2 (гидратированных), а в щелочной среде практически полностью диспропорционирует.
Выполнив аналогичные расчеты для других неметаллов – простых веществ – легко убедиться, что диспропорционирование в щелочных растворах в заметной степени свойственно всем галогенам (кроме фтора), халькогенам и фосфору.
б) нейтральная среда:
MnO42–+ 2e +2H2O « MnO2 + 4OH– Е0ок. = +0,6 B,
MnO42– « MnO4– + e Е0восст. = +0,56 B
ЭДС = Е0ок – Е0восст = 0,6 – 0,56 = + 0,04 B.
кислая среда:
MnO42–+ 2e + 8H+ « Mn2+ + 4H2O Е0ок = +1,51 B,
MnO42– « MnO4– + e Е0восст = +0,56 B
ЭДС = Е0ок – Е0восст = 1,51 – 0,56 = + 0,95 B.
Таким образом, манганат–ионы практически не существуют в кислой среде (и заметно диспропорционируют в нейтральной и слабощелочной средах).
Диаграммы Латимера
Диаграммы Латимера применяют в случаях, когда в справочнике нет данных по величине необходимого Е0. Расчет базируется на том, что поскольку в уравнении DG0х.р. = – n×F×E0х.р., F – постоянная величина, то n×E0х.р., как и DG0х.р., должно подчиняться закону Гесса. Т.е. сумма n×E0 ряда последовательных превращений должна равняться n×E0 превращения из начального в конечное состояние.
Например, для последовательности Cl– ® Cl2 ® ClO3– ® ClO4– диаграмма Латимера выглядит так (над стрелками показано число электронов, участвующих в превращении, под стрелками – соответствующие Е0, В):
2e 10e 4e
2Cl– ® Cl2 ® 2ClO3– ® 2ClO4–
+1,35 +1,47 +1,19
16e
½¾¾¾¾¾¾¾¾¾¾¾¾¾¾½
+1,38
При этом должно выполняться равенство:
2×1,35 +10×1,47 + 4×1,19 = 16×1,38 В.
Если потенциал одного из превращений неизвестен, например,
Cl2 ® 2ClO3–, то его легко рассчитать: 2×1,35 + 10х + 4×1,19 = 16×1,38; откуда х = (16×1,38 – 2×1,35 – 4×1,19):10 = 1,46 В (что всего на 0,01 В отличается от фактической величины 1,47 В).
13 Коррозия металлов
Коррозией (corrosio – разъедание, лат.) называют процесс (и результат) окисления металла под действием окружающей среды, ведущее к изменению эксплуатационных свойств металла. В зависимости от природы и механизма окисления различают коррозию химическую, электрохимическую, биологическую и др. Здесь мы рассмотрим только два первых вида коррозии, причем более подробно – электрохимическую коррозию.
Химическая коррозия металлов.
В зависимости от среды различают два вида химической коррозии:
в жидкостях – неэлектролитах и газовую коррозию.
Жидкости-неэлектролиты – это жидкие неэлектропроводные химически активные среды, способные выступать в отношении металла в качестве окислителя (жидкий бром, нефть и нефтепродукты и др.).
Газовая коррозия – наиболее часто встречающийся вариант химической коррозии, которая протекает особенно интенсивно при высоких температурах. Среди газообразных коррозирующих реагентов самые распространенные это O2, SO2, Cl2, H2O, H2S, оксиды азота и др.
Например, процессы химической коррозии в атмосфере таких газов можно описать следующими уравнениями:
2Fe + SO2 ® 2FeO + FeS 4Fe + 3O2 ® 2Fe2O3
Fe + H2 O ® FeO + H2 Fe + CO2 ® FeO + CO
Fe + SO2 + H2 O ® FeSO3 + H2
При окислении кислородом поверхность некоторых металлов, например алюминия, свинца и др. покрывается прочной оксидной пленкой; в результате этого металлы далее не корродируют.
Электрохимическая коррозия.
Электрохимической коррозией называется разрушение металлов в результате их электрохимического окисления. Если учесть, что в электрохимических системах реакции окисления протекают на аноде, то при электрохимической коррозии анодом оказывается разрушающийся металл. Причем, таковым он может стать или в результате образовавшейся гальванопары (так называемая гальванокоррозия) или в результате анодной поляризации его от внешнего источника тока.
Рассмотрим варианты гальванокоррозии металлов. В реальных условиях мы редко имеем дело с химически чистыми металлами, они всегда включают примеси, естественные или искусственно введенные (например, в сплавах), находящиеся в электрическом контакте с основным материалом (таким образом обеспечивается внешняя цепь гальванического элемента). При контакте с электролитом, например влагой, возникает разность потенциалов (второе условие работы гальванического элемента), и, если в растворе имеется потенциальный окислитель (его называют деполяризатором), то протекает электрохимический процесс, при котором окисляется металл с меньшим электродным потенциалом.
Подобные ситуации могут реализоваться также
– в пограничной области металл/оксид металла,
– покрашенного и неокрашенного участков металла,
– участков металла с различной кристаллической структурой (например, в результате неравномерной термообработки),
– при перепаде концентрации электролита или разницы в температуре различных участков металла и т.д.
Как протекает гальванокоррозия?
Пример 1. Рассмотрим гальванокоррозию при контакте цинка с медью. Если их поверхность покрывается водяной пленкой, то в результате процессов, описанных ранее, образуются два двойных электрических слоя:
Zn « Zn2+ + 2e
Cu « Cu2+ + 2e–
Электродный потенциал цинка меньше (в электрохимическом ряду металлов он расположен левее меди), поэтому на цинковом электроде электронов оказывается больше, чем на медном; вследствие чего произойдет перераспределение электронов с переходом их с цинка на медь. При этом оба указанные выше равновесия изменятся: дополнительное количество катионов цинка перейдет в раствор, и эквивалентное количество ионов меди восстановится из раствора на медном электроде. Если бы ионов меди в растворе было достаточно (например, в растворе медного купороса), то описанный процесс протекал бы подобно гальваническому элементу, что привело бы к заметному окислению (коррозии) цинка. Однако в рассматриваемой модели ионов меди в растворе очень мало, и единственным потенциальным окислителем могут быть молекулы воды. В этом случае, в нейтральной среде, анодный (на цинке) и катодный (на меди) процессы можно описать следующими уравнениями:
Анодный процесс: Zn = Zn2+ + 2e
Катодный процесс: H2O + 2e = H2 + 2OH–
_______________________________________________
Суммарное уравнение: Zn + H2O = Zn2+ + 2OH– + H2 = Zn(OH)2 + H2
В результате цинк (анод) окисляется, а на катоде (медном) восстанавливаются ионы водорода из воды. Поверхность цинка покроется тонкой пленкой малорастворимого гидроксида, и процесс прекратится практически мгновенно, коррозии не будет.
В реальных условиях окислителей – «деполяризаторов» гораздо больше – это растворенные в воде кислород, оксиды азота, серы, сероводород и др. В зависимости от того, какое вещество выполняет функцию окислителя (O2, H+ и др.) различают электрохимическую коррозию с кислородной, водородной или др. деполяризацией катода.
Пример 2. Рассмотрим вариант гальванокоррозии тех же металлов, цинка в контакте с медью, в кислой среде. В этом случае окислителем – деполяризатором будут ионы водорода:
Анодный процесс: Zn = Zn2+ + 2e
Катодный процесс: 2H+ + 2e = H2
____________________________________
Суммарное уравнение: Zn + 2H+ = Zn2+ + H2
Обратите внимание, что, как и в предыдущем примере, в результате электрохимической реакции окисляется анод - цинк, но при этом окислитель – водород восстанавливается на катоде – медном электроде.
Пример 3. В той же системе, в кислой среде, но в присутствии молекулярного кислорода процессы отличаются: имеются уже два потенциальных деполяризатора – кислород и ионы водорода. Очевидно, что первым должен восстанавливаться окислитель более сильный, в данном случае – O2 (в общем случае – окислитель с большим электродным потенциалом).
Анодный процесс: Zn = Zn2+ + 2e
Катодный процесс: O2 + 4H+ + 4e = 2H2O
___________________________________________
Суммарное уравнение: 2Zn + O2 + 4H+ = 2Zn2+ + 2H2O
Пример 3. Что изменится в той же системе, если среда будет щелочной?
Анодный процесс: Zn = Zn2+ + 2e
Катодный процесс: O2 + 2H2O + 4e = 4OH–
___________________________________________
Суммарное уравнение: 2Zn + O2 + 2H2O = 2Zn2+ + 4OH– = 2Zn(OH)2
В щелочной среде образуется растворимый гидроксокомплекс: вторичный процесс Zn(OH)2 + 2OH– = [Zn(OH)4]2– , и в этих условиях цинк будет подвергаться коррозии.
Способы защиты от электрохимической коррозии.
Гальванокоррозию можно предотвратить, если нарушить хотя бы одно из условий, необходимых для работы потенциального гальванического элемента: наличие внешней или внутренней электрических цепей, наличие веществ – деполяризаторов.
Самый простой способ – изолировать защищаемый металл от окружающей среды с помощью различных покрытий: пластиками, красителями, другими металлами и т.п.
В случаях покрытия одного металла другим металлом контактировать с окружающей средой и окисляться будет уже металл покрытия.
Что произойдет, если покрытие хотя бы частично разрушится? – Образуется гальванопара, и в зависимости от природы контактирующих металлов анодом может стать либо покрытие, либо защищаемый металл.
В зависимости от того, больший или меньший электродный потенциал имеет металл покрытия по сравнению с электродным потенциалом защищаемого металла, покрытия могут быть катодными или анодными,
Катодное покрытие – это покрытие металла другим металлом
с большим электродным потенциалом.
Если металл покрытия имеет меньший электродный потенциал, по сравнению с защищаемым, то такое покрытие называют анодным.
Рассмотрим пример выбора металла покрытия и механизм его защитного действия. Если защищаемый металл, например, железо, стандартный электродный потенциал которого E0 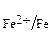 = – 0,44 B, то роль катодного покрытия может выполнить металл с большим электродным потенциалом (расположенный правее, чем железо в электрохимическом ряду). Такими металлами могут быть, например, никель, E0
= – 0,44 B, то роль катодного покрытия может выполнить металл с большим электродным потенциалом (расположенный правее, чем железо в электрохимическом ряду). Такими металлами могут быть, например, никель, E0 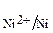 = – 0,23 B, олово, E0
= – 0,23 B, олово, E0  = – 0,14 B, медь, E0
= – 0,14 B, медь, E0 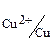 = + 0,34 B, и др.
= + 0,34 B, и др.
Безусловно, эти металлы, контактируя с окружающей средой, сами могут корродировать (химическая коррозия); однако они химически менее активны, чем железо и, в отличие от него, при окислении они покрываются прочными защитными пленками (Sn) или вообще не окисляются при н.у. (Ni).
Что произойдет, если такое покрытие окажется механически поврежденным? – Образуется гальванический элемент, и протекает гальванокоррозия (с вариантами, описанными ранее), в результате которой окисляется защищаемый металл (железо), т.к. его электродный потенциал меньше. Например, в кислой среде (см. рис. 3–а):
Анодный процесс (Fe): Fe = Fe2+ + 2e
Катодный процесс (Ni): 2H+ + 2e = H2 ______________________________________________________
Суммарное уравнение: Fe + 2H+ = 2Fe2+ + H2
Анодное покрытие – это покрытие защищаемого металла другим металлом, с меньшим электродным потенциалом.– Металл покрытия химически более активен, но его выбирают таким, чтобы он, окисляясь, покрывался защитной пленкой; чаще всего – это цинковое покрытие (см. рис. 3–б). При механическом повреждении металл-покрытие поляризуется анодно и корродирует, а защищаемый металл не окисляется, т.к. поляризуется катодно. (Уравнения протекающих при этом реакций аналогичны рассмотренным ранее для пары металлов цинк/медь).
При сравнении катодного и анодного покрытий становится понятным, что выбор их определяется как агрессивностью окружающей среды, так и вероятностью механического повреждения покрытия: чем больше вероятность нарушения покрытия, тем более эффективно анодное покрытие. (Попробуйте теперь ответить на вопрос: почему крышки для консервирования обычно «лудят», т.е. покрывают оловом, а железо для кровли – «оцинковывают»?)

|
Рис. 3 Схема электрохимической коррозии в кислой среде при нарушении защитного покрытия: (а) – Ni (катодного) и (б) – цинкового (анодного): 1 – окружающая среда (рН < 7); 2 – материал покрытия; 3 – защищаемый металл (Fe).
Протекторная защита. По механизму защитного действия этот вариант аналогичен анодному покрытию: при образовании гальванопары корродирует не защищаемый металл, а металл-«протектор». В качестве «протектора» выбирают металл с меньшим электродным потенциалом. Чаще всего это цинковая пластина, один конец которой погружают в раствор, а другой приваривают к защищаемому металлу:
Анодный процесс: Zn = Zn2+ + 2e
Катодный процесс: O2 + 4H+ + 4e = 2H2O
___________________________________________
Суммарное уравнение: 2Zn + O2 + 4H+ = 2Zn2+ + 2H2O
Протекторная защита имеет несомненное преимущество перед анодным покрытием вследствие более простой технологии ее исполнения и восстановления: окислившийся протектор легко заменить на новый. Такой вариант защиты применяют, например, в водонагревательных котлах.
Катодная защита. Отличие этого способа заключается в том, что защищаемый металл, независимо от его природы, поляризуют катодно от внешнего источника тока (к защищаемому металлу подключают (–) от аккумулятора). Анодно поляризуют любой металлический «хлам» (металлолом), подключая к нему (+) от аккумулятора. В результате гальванокоррозии окислители окружающей среды восстанавливаются на защищаемом металле электронами от внешнего источника тока, а окисляется «хлам». Такой способ защиты чаще всего применяют для крупных, протяженных конструкций (например, трубопроводов).
Анодная защита. Этот способ защиты металлов обеспечивается подобно описанному выше, но защищаемый металл, на короткое время, поляризуется анодно. На первый взгляд вариант абсурден, т.к. при анодной поляризации интенсифицируется процесс окисления металла. Однако, если это металл, оксидная пленка которого выполняет защитную (изолирующую) функцию, как на алюминии, например, то при анодной поляризации она образуется более плотной и равномерной.
Электролиз
Электролизом называют совокупность гетерогенных окислительно-восстановительных реакций, протекающих в растворе или расплаве электролита на поверхности электродов, поляризованных анодно или катодно от внешнего источника тока.
На электрод, поляризованный катодно (–), от внешнего источника тока поступают электроны. Вследствие этого у катода концентрируются противоионы (катионы) – потенциальные окислители. У электрода, поляризованного анодно (+), концентрируются анионы – потенциальные восстановители. В качестве окислителей и восстановителей при электролизе могут быть не только ионы, но и электронейтральные молекулы растворенных веществ. Потенциальным восстановителем может быть и металл, из которого изготовлен анод; в этом случае анод называют «активным».
Обратите внимание, что в электролизере и гальваническом элементе анод и катод имеют обратные знаки: в гальваническом элементе анод имеет знак (–), а в электролизере знак (+); катод в гальваническом элементе (+), в электролизере (–). В то же время, есть одно общее в работе этих устройств:
и в гальваническом элементе, и в электролизере на аноде протекают реакции окисления, а на катоде – реакции восстановления. Соответственно меняется и расчет 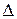 Е = ЭДС (в электролизе его называют потенциалом разложения вещества):
Е = ЭДС (в электролизе его называют потенциалом разложения вещества):
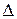 Е = Еокисл. – Евосст. = Еанода – Екатода (6)
Е = Еокисл. – Евосст. = Еанода – Екатода (6)
Как отмечалось ранее, наличие потенциальных окислителя и восстановителя является необходимым, но недостаточным условием для того, чтобы реакция между ними действительно протекала: необходимо, чтобы ЭДС реакции была положительной величиной.
Например, рассчитаем ЭДС электролитического разложения воды:
Катодный процесс: 2H2O + 2е = H2 + 2OH– Е0 = – 0,41 В
Анодный процесс: 2H2O = O2 + 4H+ + 4е Е0 = + 0,82 В
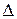 Е0 =ЭДС = 0,82 – (– 0,41) = 1,23 В
Е0 =ЭДС = 0,82 – (– 0,41) = 1,23 В
Таким образом, для электролитического разложения воды требуется ЭДС не менее 1,23 В.
Если в растворе (расплаве) электролита имеются несколько веществ, способных окисляться или восстанавливаться, то, как и в обычных окислительно-восстановительных реакциях последовательность превращений на соответствующих электродах определяется величинами их электродных потенциалов: первым должен окисляться восстановитель с меньшим электродным потенциалом, а восстанавливаться – окислитель с большим электродным потенциалом. Выбор их для стандартных условий делают с помощью «Таблиц электродных потенциалов». При этом следует иметь в виду, что кроме энергетики превращения нередко определяющим оказывается кинетический фактор, в том числе и специфический для электрохимических реакций – явление «перенапряжения».
Перенапряжение.
В большинстве случаев для электрохимического превращения веществ ЭДС источника тока, подключаемого к электролизеру, должна быть больше ЭДС реакции. Причин этого много, но среди них есть специфическая, для случаев, когда продуктами электролиза оказываются газообразные вещества, чаще всего – молекулярные водород и кислород. Дело в том, что эти газы способны сорбироваться на поверхности многих металлов, образуя тонкую пленку, изолирующую электрод. Для того чтобы электролиз протекал с необходимой скоростью, требуется дополнительная ЭДС, которую называют перенапряжением.
На некоторых металлах (Pb, Hg, Pt) перенапряжение превышает 1 В, и вследствие этого может существенно меняться последовательность восстановления (окисления) веществ на электродах. Например, при электролизе с ртутным катодом из водного раствора можно восстановить даже щелочные металлы (при этом есть еще одна особенность, не менее важная, чем перенапряжение: эти металлы, восстановившись, растворяются в ртути, образуют амальгаму, и оказываются вне контакта с водой).
Вследствие того, что перенапряжение для кислорода больше, чем для хлора, при электролизе растворов хлоридов на аноде первыми окисляются хлорид-ионы, а не молекулы воды.
Рассмотрим несколько примеров электролиза.
Пример 1. Определить, какие вещества окисляются на аноде и восстанавливаются на катоде при электролизе водного раствора сульфата калия с инертным анодом. Написать уравнения анодного и катодного процессов. Как меняется pН в процессе электролиза этого раствора?
Решение: Определим состав электролита:
K2SO4 ® 2K+ + SO42– H2O « H+ + OH–
На положительно заряженном аноде могут окисляться молекулы воды или сульфат-ионы:
Анод(+): 2H2O = O2 + 4H+ 4е Е0 = + 0,82 В
2SO42– = S2O82– + 2e Е0 = + 2,0 B
Из двух потенциальных восстановителей более сильный – вода, т.к. ее окислению соответствует меньший электродный потенциал.
На отрицательно заряженном катоде могут восстанавливаться ионы калия или водород из воды:
Катод (–): K+ + е = К Е0 = – 2,92 В
2H2O + 2е = H2 + 2OH– Е0 = – 0,41 В
Восстановлению водорода соответствует больший электродный потенциал, следовательно, вода – более сильный окислитель, и поэтому на катоде будет восстанавливаться водород из воды.
Таким образом, при электролизе заданного раствора будут протекать реакции:
Анод (+): 2H2O = O2 + 4H+ + 4е 1
 Катод(–): 2H2O + 2е = H2 + 2OH– 2
Катод(–): 2H2O + 2е = H2 + 2OH– 2
Суммарное уравнение: 2H2O = O2 + 2H2
Как видно из уравнения реакции кислотность раствора (pH) при электролизе сульфата калия не меняется.
Подобные варианты электролиза применяются в промышленности для получения водорода и кислорода из воды.
Примечание:
Электродные потенциалы окисления оксоанионов неметаллов в высших степенях окисления гораздо больше, чем для окисления воды, поэтому их можно не рассматривать в качестве потенциальных восстановителей при электролизе водных растворов.
Электродные потенциалы восстановления катионов щелочных и щелочноземельных металлов гораздо меньше, чем для восстановления водорода воды, поэтому в дальнейшем ихможно не рассматривать в качестве потенциальных окислителей при электролизе водных растворов.
Пример 2. Определить, какие вещества окисляются на аноде и восстанавливаются на катоде при электролизе водного раствора хлорида железа(III) с инертным анодом. Написать уравнения анодного и катодного процессов. Как меняется pН в процессе электролиза этого раствора?
Решение: Определим состав электролита:
FeCl3 ® Fe3+ + 3Cl– H2O « H+ + OH–
На положительно заряженном аноде возможно окисление воды или хлорид-ионов:
Анод(+): 2H2O = O2 + 4H+ + 4е Е0 = + 0,82 В
2Cl– = Cl2 + 2e Е0 = + 1,35 B
Из двух восстановителей более сильный – тот, для которого электродный потенциал меньше, – это вода, поэтому энергетически более выгоден процесс восстановления воды. Однако, вследствие того, что перенапряжение для кислорода больше, чем для галогенов, и с учетом того, что анионы хлора быстрее мигрируют к аноду по сравнению с электронейтральными молекулами воды, на аноде будут преимущественно окисляться хлорид-ионы:
Анод(+): 2Cl– = Cl2 + 2e Е0 = + 1,35 B
Какие вещества могут восстанавливаться на катоде?
Катод (–): 2H2O + 2е = H2 + 2OH– E = – 0,41 B
Fe3+ + e = Fe2+ E0 = + 0,77 B
Имеются два потенциальных окислителя, H2O и Fe3+. Более сильный – тот, для которого электродный потенциал больше, – это Fe3+, Следовательно, на катоде будет восстанавливаться Fe3+, и тогда электролизу FeCl3 соответствуют следующие уравнения анодного и катодного процессов:
Анод (+): 2Cl– = Cl2 + 2e– ç1
Катод (–): Fe3+ + e = Fe2+ ç 2
________________________________
Суммарное уравнение: 2FeCl3 = 2FeCl2 + Cl2
Возможно ли дальнейшее восстановление железа Fe2+ + e = Fe?
По справочным данным E0Fe2+/Fe = – 0,44 B. Вследствие того, что электродный потенциал этого превращения меньше, чем для восстановления воды, к тому же концентрация H2O гораздо больше, чем железа, после реакции Fe3+ + e = Fe2+ при продолжении электролиза будет преимущественно протекать реакция
2H2O + 2е = H2 + 2OH–
При этом pH раствора должен увеличиваться. Однако, вследствие параллельно протекающей ионно-молекулярной реакции
Fe2+ + 2OH– = Fe(OH)2
гидроксид-ионы связываются, pH раствора увеличится незначительно.
Пример 3. Определить, какие вещества окисляются на аноде и восстанавливаются на катоде при электролизе водного раствора сульфата никеля с никелевым анодом. Написать уравнения анодного и катодного процессов. Как меняется pH и концентрация соли в процессе электролиза этого раствора?
Какие изменения будут в электролизе того же раствора, если анод заменить графитовым («пассивным»)? Напишите уравнения катодного и анодного процессов.
Решение: Определим состав электролита:
NiSO4 ® Ni2+ +SO42– H2O « H+ + OH–
На положительно заряженном аноде возможно окисление воды и сульфат-ионов (последние исключим, см. примечание выше). Кроме того, возможно окисление самого анода:
Анод (+): 2H2O = O2 + 4H+ + 4е Е0 = + 0,82 В
Ni = Ni2+ + 2e Е0 = – 0,23 B
Из двух потенциальных восстановителей более сильный тот, для которого электродный потенциал меньше – это никель (следовательно – это электролиз с активным анодом).
Какие вещества могут восстанавливаться на катоде?
Катод(–): 2H2O + 2е = H2 + 2OH– E0 = – 0,41 B
Ni2+ + 2e = Ni E0 = – 0,23 B
Из двух потенциальных окислителей более сильный – ионы никеля, (электродный потенциал больше), поэтому на катоде будут восстанавливаться катионы никеля. Следовательно, уравнения анодного и катодного процессов электролиза раствора сульфата никеля будут следующие:
Анод (+):Ni = Ni2+ + 2e
Катод (–): Ni2+ + 2e = Ni
Суммарное уравнение: Ni + Ni2+ = Ni2+ + Ni
Ni + NiSO4 = NiSO4 + Ni
Таким образом, при электролизе этого раствора окисляется никелевый анод, а на катоде катионы никеля восстанавливаются. (Кислотность раствора не меняется).
Подобные варианты электролиза применяются в промышленности для очистки («электрорафинирования») многих цветных металлов.
Что изменится, если никелевый анод заменить графитовым («пассивным») анодом?
– Изменится анодный процесс:
Анод (+): 2H2O = O2 + 4H+ + 4е
и тогда электролизу будут соответствовать следующие уравнения:
Анод (+): 2H2O = O2 + 4H+ + 4е
Катод (–): Ni2+ + 2e = Ni
Суммарное уравнение: 2H2O + Ni2+ = O2 + Ni + 4H+
2H2O + NiSO4 = O2 + Ni + 2H2SO4
П
Дата добавления: 2020-07-18; просмотров: 562;











