Произведение растворимости
Гидролиз солей
Гидролиз – это частный случай обменных реакций, в которых реальные или потенциальные ионы растворенного вещества заменяются на ионы воды.
Обменные реакции, в которых в которых составные части растворенного вещества связываются с ионами воды, образуя слабые кислоты и (или) слабые основания, называют реакциями гидролиза.
Как и другие реакции обмена, гидролиз возможен в случае, если его продуктами оказываются слабые электролиты (или неэлектролиты), а также малорастворимые продукты (твердые или газообразные).
Гидролизу подвергаются многие вещества, как органические, так и неорганические: соли, галогенангидриды, эфиры, жиры и др.
При растворении солей в воде большинство их под влиянием молекул растворителя полностью диссоциируют на катионы и анионы:
KatxAy  xKaty+ + yAx–
xKaty+ + yAx–
Вода – один из слабейших неорганических электролитов – хотя и в малой степени, но также диссоциирует на ионы, при этом одновременно с реакцией диссоциации протекает обратная реакция – ассоциация ионов H+ и OH– с образованием молекул воды: HOH  H+ + OH–
H+ + OH–
В чистой воде молярные концентрации ее ионов одинаковы, поэтому pH = 7 (см. тему «Диссоциация электролитов»). Если в растворе появляются ионы соли, то баланс между ионами H+ и OH– может нарушиться. Так, если катионам соли соответствует слабое основание, то они могут конкурировать с ионами водорода за связывание гидроксид-ионов, в результате чего ионы H+ окажутся в избытке, и раствор будет подкисляться:
Katy+ + H–OH  (Kat–OH)(y–1)+ + H+
(Kat–OH)(y–1)+ + H+
Если анионам соли соответствует слабая кислота, то они могут конкурировать с гидроксид-ионами за связывание ионов водорода, в результате чего ионы OH– окажутся в избытке, раствор будет подщелачиваться:
Ax– + H–OH  (H–A)(x–1)– + OH–
(H–A)(x–1)– + OH–
Таким образом, из солей гидролизуются те, в состав которых входят катионы слабого основания и (или) анионы слабой кислоты. Чем слабее электролит, образующийся при гидролизе, тем более полно протекает гидролиз.
Если заряды (x, y) гидролизующихся ионов соли больше единицы, то такие реакции протекают в несколько стадий (ступеней).
Например, катионы алюминия, связывая гидроксид-ионы воды, могут образовать гидроксоалюминат –, дигидроксоалюминат – катионы и молекулы гидроксида: Al3+ + HOH  AlOH2+ + H+ – первая ступень
AlOH2+ + H+ – первая ступень
AlOH2+ + HOH  Al(OH)2+ + H+ – вторая ступень
Al(OH)2+ + H+ – вторая ступень
Al(OH)2+ + HOH  Al(OH)3 + H+ – третья ступень
Al(OH)3 + H+ – третья ступень
Сульфид-ионы могут связывать ионы водорода, образуя гидросульфид – ионы и молекулы сероводорода:
S2– + HOH  HS– + OH– – первая ступень
HS– + OH– – первая ступень
HS– + HOH  H2S + OH– – вторая ступень
H2S + OH– – вторая ступень
Уравнения реакций гидролиза
При написании ионных и молекулярных реакций гидролиза рекомендуется следующая последовательность их составления:
а) написать уравнение диссоциации соли и выделить ионы, способные участвовать в гидролизе;
б) написать уравнение реакции этих ионов с молекулами воды (сокращенное ионно-молекулярное уравнение гидролиза);
в) добавить в уравнение (б) ионы соли, не участвующие в гидролизе (получится полное ионно-молекулярное уравнение);
г) соединить катионы и анионы в левой и правой частях уравнения (в) с образованием соответствующих электролитов (получится молекулярное уравнение гидролиза).
Примеры:
Гидролиз солей слабых оснований:
– соли образованные однозарядным катионом слабого основания:
NH4NO3  NH4+ + NO3– – уравнение диссоциации
NH4+ + NO3– – уравнение диссоциации
(выделены ионы слабого основания, NH4+)
NH4+ + HOH  NH3*H2O + H+ – сокращенное ионно – молекулярное уравнение из которого видно, что раствор кислый, его pH < 7
NH3*H2O + H+ – сокращенное ионно – молекулярное уравнение из которого видно, что раствор кислый, его pH < 7
NH4+ + NO3– + HOH  NH3*H2O + H+ + NO3– – полное ионно-молекулярное уравнение (в левую и правую части добавили NO3–)
NH3*H2O + H+ + NO3– – полное ионно-молекулярное уравнение (в левую и правую части добавили NO3–)
NH4NO3 + H2O  NH3*H2O + HNO3 –молекулярное уравнение
NH3*H2O + HNO3 –молекулярное уравнение
гидролиза
– соли образованные многозарядным катионом слабого основания и однозарядным анионом сильной кислоты (CuCl2, Al(NO3)3 и др.):
CuCl2  Cu2+ + 2Cl– – уравнение диссоциации (выделены ионы
Cu2+ + 2Cl– – уравнение диссоциации (выделены ионы
слабого основания, Cu2+)
В гидролизе участвуют многозарядные катионы Cu2+, поэтому реакция протекает ступенчато.
Первая ступень:
Cu2+ + HOH  CuOH++ H+ – сокращенное ионно – молекулярное уравнение,
CuOH++ H+ – сокращенное ионно – молекулярное уравнение,
Cu2+ + 2Cl– + HOH  CuOH++ H+ + 2Cl–– полное ионно-молекулярное уравнение (в левую и правую части добавили 2Cl–)
CuOH++ H+ + 2Cl–– полное ионно-молекулярное уравнение (в левую и правую части добавили 2Cl–)
CuCl2 + H2O  (CuOH)Cl + HCl –молекулярное уравнение
(CuOH)Cl + HCl –молекулярное уравнение
Вторая ступень:
CuOH+ + HOH  Cu(OH)2 + H+ – сокращенное ионно – молекулярное уравнение,
Cu(OH)2 + H+ – сокращенное ионно – молекулярное уравнение,
CuOH+ + Cl– + HOH  Cu(OH)2+ H+ + Cl–– полное ионно-молекулярное уравнение (в левую и правую части добавили Cl–)
Cu(OH)2+ H+ + Cl–– полное ионно-молекулярное уравнение (в левую и правую части добавили Cl–)
(CuOH)Cl + H2O  Cu(OH)2+ HCl –молекулярное уравнение
Cu(OH)2+ HCl –молекулярное уравнение
Внимание: Иногда уравнения ступенчатого гидролиза объединяют в одно «общее уравнение»: CuCl2 + H2O  Cu(OH)2 + 2HCl.
Cu(OH)2 + 2HCl.
Делать это не следует, т.к. такое «уравнение» не отражает ни фактическое соотношение реагентов, ни качественный состав продуктов (об этом говорилось и ранее, см. «ступенчатую диссоциацию электролитов»).
– соли, образованные многозарядным катионом слабого основания и многозарядным анионом сильной кислоты (CoSO4, Cr2(SO4)3 и др.).
Если в состав соли, гидролизующейся соли входят многозарядные ионыто при переходе от полного ионно-молекулярного уравнения к молекулярному может понадобиться дополнительная операция – введение множителя:
а) CoSO4  Co2+ + SO42– – уравнение диссоциации
Co2+ + SO42– – уравнение диссоциации
(выделены ионы слабого основания, Co2+)
Первая ступень гидролиза:
Co2+ + HOH  CoOH++ H+ – сокращенное ионно – молекулярное уравнение,
CoOH++ H+ – сокращенное ионно – молекулярное уравнение,
Co2+ + SO42– + HOH  CoOH++ H+ + SO42–– полное ионно-молекулярное уравнение (в левую и правую части добавили SO42–)
CoOH++ H+ + SO42–– полное ионно-молекулярное уравнение (в левую и правую части добавили SO42–)
В отличие от примера 2 в правой части полученного уравнения – один сульфат-ион на два разных катиона, CoOH+и H+. В подобных случаях необходимо удвоить все коэффициенты в полном ионно-молекулярном уравнении: 2Co2+ + 2SO42– + 2HOH  2CoOH++ 2H+ + 2SO42–
2CoOH++ 2H+ + 2SO42–
Соединив катионы с анионами, получим молекулярное уравнение:
2CoSO4 + 2H2O  (CoOH)2SO4 + H2SO4
(CoOH)2SO4 + H2SO4
Вторая ступень гидролиза:
В гидролизе по второй ступени участвуют ионы CoOH+ – продукт первой ступени гидролиза:
CoOH+ + HOH  Co(OH)2+ H+– сокращенное ионно – молекулярное
Co(OH)2+ H+– сокращенное ионно – молекулярное
уравнение
При написании полного ионно-молекулярного уравнения учтем, что в состав (CoOH)2SO4 входят два катиона CoOH+, потому полученное сокращенное ионно – молекулярное уравнение сначала удвоим:
2CoOH+ + 2HOH  2Co(OH)2 + 2H+, а затем добавим в левую и правую его части по SO42–:
2Co(OH)2 + 2H+, а затем добавим в левую и правую его части по SO42–:
2CoOH+ + SO42– + 2HOH  2Co(OH)2+ 2H+ + SO42–
2Co(OH)2+ 2H+ + SO42–
Соединив катионы с анионами, получим молекулярное уравнение:
(CoOH)2SO42– + 2HOH  2Co(OH)2+ H2SO4
2Co(OH)2+ H2SO4
Если в состав соли входят не один, а несколько катионов (или анионов), участвующих в гидролизе, то сокращенное ионно-молекулярное уравнение пишут сначала для одного иона, а затем полученное уравнение умножают на соответствующий коэффициент.
б) Cr2(SO4)3  2Cr3+ + 3SO42– – уравнение диссоциации
2Cr3+ + 3SO42– – уравнение диссоциации
Первая ступень гидролиза:
Cr3+ + HOH  CrOH2++ H+ – сокращенное ионно – молекулярное уравнение,
CrOH2++ H+ – сокращенное ионно – молекулярное уравнение,
Учитывая, что в состав соли входят два катиона хрома, умножим на два левую и правую части полученного равнения:
2Cr3+ + 2HOH  2CrOH2+ + 2H+
2CrOH2+ + 2H+
В соответствии с уравнением диссоциации добавив в левую и правую части соответствующее число сульфат-ионов, по три, получим полное ионно-молекулярное уравнение:
2Cr3+ + 3SO42– + 2HOH  2CrOH2++ 2H+ + 3SO42–
2CrOH2++ 2H+ + 3SO42–
Соединив катионы с анионами, получим молекулярное уравнение:
Cr2(SO4)3 + 2H2O  2(CrOH)SO4 + H2SO4
2(CrOH)SO4 + H2SO4
Вторая ступень:
CrOH2+ + HOH  Cr(OH)2++ H+ – сокращенное ионно –
Cr(OH)2++ H+ – сокращенное ионно –
молекулярное уравнение,
2CrOH2+ + 2HOH  2Cr(OH)2+ + 2H+
2Cr(OH)2+ + 2H+
2CrOH2+ + 2SO42– + 2HOH  2Cr(OH)2+ + 2H+ + 2SO42–– полное ионно
2Cr(OH)2+ + 2H+ + 2SO42–– полное ионно
молекулярное уравнение,
2Cr(OH)SO4 + 2H2O  [Cr(OH)2]2SO4 + H2SO4 – молекулярное уравнение
[Cr(OH)2]2SO4 + H2SO4 – молекулярное уравнение
Третья ступень:
Cr(OH)2+ + HOH  Cr(OH)3+ H+ – сокращенное ионно –
Cr(OH)3+ H+ – сокращенное ионно –
молекулярное уравнение,
2Cr(OH)2++ 2HOH  2Cr(OH)3 + 2H+
2Cr(OH)3 + 2H+
2Cr(OH)2++ SO42– + 2HOH  2Cr(OH)3 + 2H+ + SO42– – полное ионно-
2Cr(OH)3 + 2H+ + SO42– – полное ионно-
молекулярное уравнение
[Cr(OH)2]2SO4 + 2H2O  2Cr(OH)3 + H2SO4 – молекулярное уравнение
2Cr(OH)3 + H2SO4 – молекулярное уравнение
Гидролиз солей слабых кислот:
– соли, образованные однозарядными анионами слабых кислот (KF, Ca(NO2)2 и др.):
KF  K+ + F– – уравнение диссоциации (выделены ионы слабой кислоты)
K+ + F– – уравнение диссоциации (выделены ионы слабой кислоты)
F– + HOH  HF + OH– – сокращенное ионно-молекулярное уравнение, из которого видно, что раствор при этом подщелачивается, pH >7)
HF + OH– – сокращенное ионно-молекулярное уравнение, из которого видно, что раствор при этом подщелачивается, pH >7)
F– + K+ + HOH  HF + K+ + OH– – полное ионно-молекулярное уравнение
HF + K+ + OH– – полное ионно-молекулярное уравнение
KF + H2O  HF + KOH – молекулярное уравнение
HF + KOH – молекулярное уравнение
– соли, образованные многозарядными анионами слабых кислот:
(K2S, Na2CO3 и др.):
K2S  2K+ + S2–– уравнение диссоциации (выделены ионы слабой кислоты)
2K+ + S2–– уравнение диссоциации (выделены ионы слабой кислоты)
Анионы многозарядные, поэтому гидролиз протекает ступенчато.
Первая ступень:
S2– + HOH  HS–+ OH–… – сокращенное ионно-молекулярное
HS–+ OH–… – сокращенное ионно-молекулярное
уравнение (выделен анион слабой
кислоты);
2K+ + S2– + HOH  2K+ + HS–+ OH–– полное ионно-молекулярное уравнение
2K+ + HS–+ OH–– полное ионно-молекулярное уравнение
K2S + H2O  KHS + KOH – молекулярное уравнение
KHS + KOH – молекулярное уравнение
Вторая ступень:
HS–+ HOH  H2S + OH–… – сокращенное ионно-молекулярное
H2S + OH–… – сокращенное ионно-молекулярное
уравнение
K+ + HS–+ HOH  H2S + K+ + OH–– – полное ионно-молекулярное уравнение
H2S + K+ + OH–– – полное ионно-молекулярное уравнение
KHS + H2O  H2S + KOH – молекулярное уравнение
H2S + KOH – молекулярное уравнение
Гидролиз солей слабых оснований и слабых кислот
Если в состав соли входят катионы слабого основания и анионы слабой кислоты (NH4F, NH4CN и др.) то в реакции с водой участвуют и те, и другие: катионы соли связываются с гидроксид – ионами, а анионы – с ионами водорода. Однако в большинстве случаев баланс ионов воды при этом в растворе не сохраняется, т.к. образующиеся основание и кислота по силе, как правило, разные. В результате таких реакций раствор становится кислым, если образующаяся кислота сильнее, чем основание, и щелочным, если наоборот:
а) NH4F  NH4+ + F– – уравнение диссоциации (выделены ионы слабого основания и слабой кислоты);
NH4+ + F– – уравнение диссоциации (выделены ионы слабого основания и слабой кислоты);
уравнение гидролиза по катиону
NH4+ + HOH  NH3*H2O + H+ – сокращенное ионно – молекулярное уравнение из которого видно, что в результате этой реакции раствор подкисляется;
NH3*H2O + H+ – сокращенное ионно – молекулярное уравнение из которого видно, что в результате этой реакции раствор подкисляется;
уравнение реакции по аниону
F– + HOH  HF + OH– – сокращенное ионно-молекулярное уравнение, из которого видно, что раствор при этом подщелачивается;
HF + OH– – сокращенное ионно-молекулярное уравнение, из которого видно, что раствор при этом подщелачивается;
сложив оба уравнения, получим
NH4+ + F– + HOH  NH3*H2O + HF – полное ионно-молекулярное уравнение,
NH3*H2O + HF – полное ионно-молекулярное уравнение,
объединив катионы с анионами в левой части, получим
NH4F + H2O  NH3*H2O + HF –молекулярное уравнение
NH3*H2O + HF –молекулярное уравнение
Для определения реакции среды, сравним константы диссоциации KHF= 6×10–4 и KNH3*H2O = 1,8×10–5. Вследствие того, что константа кислоты больше, чем основания, раствор будет кислым (pH < 7).
Необратимый (полный) гидролиз
Если катиону соли соответствует слабое малорастворимое основание, а аниону – слабая малорастворимая кислота, то такие соли гидролизуются полностью, необратимо; в водных растворах они не существуют и не образуются (сульфиды алюминия, хрома(III), их карбонаты и др.)
Например, сульфид алюминия можно получить сплавлением алюминия с серой, но при растворении в воде он полностью гидролизуется, при этом выделяются малорастворимые Al(OH)3 – осадок и H2S – газ:
Al2S3 + 6HOH  2Al(OH)3
2Al(OH)3  + 3H2S
+ 3H2S  .
.
Необратимый гидролиз протекает и в тех случаях, когда соответствующие катионы и анионы оказались в растворе не из одной соли, а из разных. Например, при смешении растворов хлорида алюминия и сульфида натрия результат будет аналогичным рассмотренному выше, т.к. в растворе оказались одновременно те же ионы, Al3+ и S2–:
AlCl3 + Na2S + HOH  Al(OH)3
Al(OH)3  + H2S
+ H2S  + …
+ …
Коэффициенты в подобных уравнениях расставляются на основании того, что заряд гидролизующегося катиона становится множителем перед гидролизующимся анионом и наоборот. Вследствие того, что сульфид-анион двухзарядный, перед AlCl3 и Al(OH)3 ставим коэффициент «2»; вследствие того, что катион алюминия трехзарядный, перед Na2S и H2S ставим коэффициент «3»:
2AlCl3 + 3Na2S + HOH  2Al(OH)3
2Al(OH)3  + 3H2S
+ 3H2S  + …
+ …
Далее, для образования двух Al(OH)3 требуется шесть гидроксид-ионов, также как шесть ионов H+ требуется для образования трех H2S; очевидно для этого потребуется шесть H2O:
2AlCl3 + 3Na2S + 6HOH  2Al(OH)3
2Al(OH)3  + 3H2S
+ 3H2S  + …
+ …
Осталось добавить в правую часть по шесть ионов Na+ и Cl–, в виде шести NaCl:
2AlCl3 + 3Na2S + 6H2O  2Al(OH)3
2Al(OH)3  + 3H2S
+ 3H2S  + 6NaCl – молекулярное
+ 6NaCl – молекулярное
уравнение
2Al3+ + 3S2– + 6H2O  2Al(OH)3
2Al(OH)3  + 3H2S
+ 3H2S  – сокращенное ионно-молекулярное уравнение
– сокращенное ионно-молекулярное уравнение
Специфически протекает необратимый гидролиз метасолей амфотерных металлов, таких как NaAlO2, Na2ZnO2 и др. – при их гидролизе образуются гидроксокомплексы:
NaAlO2 + 2H2O  Na[Al(OH)4] – молекулярное уравнение
Na[Al(OH)4] – молекулярное уравнение
AlO2– + 2H2O  [Al(OH)4]– – ионно-молекулярное уравнение
[Al(OH)4]– – ионно-молекулярное уравнение
Гидролиз протекает вследствие того, что из слабого электролита – воды образуется еще более слабый – гидроксид-ионы.
Гидролиз кислых солей
Кислые соли (NaHCO3, NaH2PO4, KH2PO3, KHSO3, KHS и т.д.) образуют слабые многоосновные кислоты.
Вследствие того, что в состав этих солей входят анионы слабых кислот, эти соли гидролизуются, подобно рассмотренным ранее солям слабых кислот. Например, раствор NaH2PO4 подщелачивается за счет гидролиза дигидрофосфат-ионов: NaH2PO4  Na+ + H2PO4–
Na+ + H2PO4–
H2PO4– + HOH  H3PO4 + OH–
H3PO4 + OH–
В то же время, часть ионов H2PO4– не гидролизуется, а диссоциирует, в результате чего раствор подкисляется:
H2PO4–  HPO42– + H+
HPO42– + H+
Очевидно, что реакция раствора, кислая или щелочная, зависит от того, какое равновесие преобладает, гидролиз или диссоциация: если преобладает гидролиз, то раствор будет щелочным, если диссоциация – кислым. Диссоциацию электролита количественно характеризует константа диссоциации; равновесие гидролиза, по-видимому, – константа гидролиза, о чем мы пока не говорили. Поэтому к вопросу о pH в растворах кислых солей вернемся чуть позже.
Применение закона действующих масс к равновесию гидролиза. Константа гидролиза.
Константа гидролиза количественно характеризует глубину протекания реакции: чем сильнее гидролизуется соль, тем больше константа гидролиза. Степень гидролиза также является его количественной характеристикой, но в отличие от константы, зависящей только от природы соли и температуры, степень гидролиза зависит еще и от ее концентрации.
а) гидролиз с участием однозарядных катионов слабых оснований или анионов слабых кислот:
NH4NO3  NH4+ + NO3–
NH4+ + NO3–
соль гидролизуется по катиону
NH4+ + HOH  NH4OH + H+
NH4OH + H+
Применив закон действующих масс к равновесию гидролиза, получим следующее уравнение:
Kгидр. =  ; обратите внимание, что в знаменатель не включена [H2O] – реагента в большом избытке (см. тему «Константа химического равновесия»).
; обратите внимание, что в знаменатель не включена [H2O] – реагента в большом избытке (см. тему «Константа химического равновесия»).
Сделав в полученном уравнении подстановку [H+] = 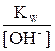 , получим следующее уравнение: Kгидр. =
, получим следующее уравнение: Kгидр. =  или
или
Kгидр. =  =
=  (7.1)
(7.1)
Из уравнения (7.1) видно, что константа гидролиза соли слабого однокислотного основания равна отношению ионного произведения воды к константе диссоциации основания. – Чем слабее основание, тем меньше его константа диссоциации, тем сильнее гидролизуется его соль.
KF  K+ + F–
K+ + F–
соль гидролизуется по аниону:
F– + HOH  HF + OH–
HF + OH–
Применив закон действующих масс к этому равновесию, получим следующее уравнение:
Kгидр. = 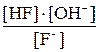 ; после подстановки [OH–] =
; после подстановки [OH–] = 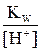 получим
получим
Kгидр. =  или
или
 =
=  (7.2)
(7.2)
Из уравнения (7.2) видно, что константа гидролиза соли слабой одноосновной кислоты равна отношению ионного произведения воды к константе диссоциации этой кислоты. – Чем слабее кислота, тем меньше ее константа диссоциации, тем сильнее гидролизуется ее соль.
NH4F  NH4+ + F–
NH4+ + F–
соль гидролизуется и по катиону, и по аниону:
NH4+ + F– + HOH  NH3*H2O + HF;
NH3*H2O + HF;
Применив закон действующих масс к этому равновесию, получим следующее уравнение:
Kгидр. = 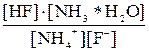 ; после умножения числителя дроби на KW, а знаменателя – на равноценную величину [H+]
; после умножения числителя дроби на KW, а знаменателя – на равноценную величину [H+] 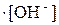 , получим
, получим
Kгидр. = 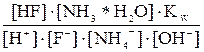 или
или
 =
=  (7.3)
(7.3)
Из уравнения (7.3) видно, что константа гидролиза соли слабого однокислотного основания и слабой одноосновной кислоты равна отношению ионного произведения воды к произведению констант диссоциации основания и кислоты.
б) гидролиз с участием многозарядных катионов слабых оснований или анионов слабых кислот (K2CO3, ZnCl2, (NH4)2S и др.):
K2CO3  2K+ + CO32–
2K+ + CO32–
Первая ступень гидролиза:
CO32– + HOH  HCO3– + OH–
HCO3– + OH–
Kгидр. =  ; умножив числитель и знаменатель на [H+], получим:
; умножив числитель и знаменатель на [H+], получим:
Kгидр. =  =
=  =
=  (7.4)
(7.4)
ZnCl2  Zn2+ + 2Cl–
Zn2+ + 2Cl–
Первая ступень гидролиза:
Zn2+ + HOH  (ZnOH)+ + H+
(ZnOH)+ + H+
Kгидр. =  ; умножив числитель и знаменатель на [OH–], получим:
; умножив числитель и знаменатель на [OH–], получим:
Kгидр. = 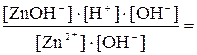
 =
=  ; (7.5)
; (7.5)
K4[Zn(OH)4]2– в уравнении (7.5) – это четвертая (последняя) константа ступенчатой диссоциации тетрагидроксоцинкат-иона.
(NH4)2S  2NH4+ + S2–
2NH4+ + S2–
Первая ступень гидролиза:
NH4+ + HOH  NH3
NH3  H2O + H+
H2O + H+
S2– + HOH  HS– + OH–
HS– + OH–
__________________________________________________
NH4+ + S2– + 2HOH  NH3
NH3  H2O + HS– + H+ + OH–
H2O + HS– + H+ + OH–
Сократив по H2O в левой и правой частях уравнения, запишем для него выражение константы равновесия:
Kгидр = 
Умножив числитель полученного уравнения на KW, а знаменатель – на равноценное [H+] [OH–], получим:
Kгидр =  =
= 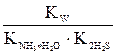 = (7.6)
= (7.6)
=  = 5,6
= 5,6 
Из величины Кгидр. следует, что сульфид аммония по первой ступени гидролизуется практически полностью, и по этой причине в водном растворе не существует и не образуется.
Если сопоставить уравнения (7.1) – (7.6), то станет очевидным, что константа гидролиза рассчитывается делением ионного произведения воды на константу диссоциации электролита, образующегося пригидролизе (или на произведение соответствующих констант, если соль гидролизуется и по катиону и по аниону).
Покажем, как применить это правило для расчета константы гидролиза гидрофосфата натрия:
Na2HPO4  2Na+ + HPO42–
2Na+ + HPO42–
HPO42– + HOH  H2PO4– + OH–
H2PO4– + OH–
Продуктом гидролиза гидрофосфат-ионов оказались дигидрофосфат-ионы – на их константу диссоциации и следует разделить ионное произведение воды: Кгидр.= 
В знаменателе дроби – 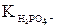 – это одна из констант диссоциации ортофосфорной кислоты, – какая из трех? Напишем уравнения ступенчатой диссоциации ортофосфорной кислоты, соответствующие им константы и определим, какая из них должна быть в знаменателе полученной дроби:
– это одна из констант диссоциации ортофосфорной кислоты, – какая из трех? Напишем уравнения ступенчатой диссоциации ортофосфорной кислоты, соответствующие им константы и определим, какая из них должна быть в знаменателе полученной дроби:
H3PO4  H+ + H2PO4– K1 =
H+ + H2PO4– K1 = 
H2PO4–  H+ + HPO42– K2 = 6
H+ + HPO42– K2 = 6 
HPO42–  H+ + PO43– K3 =
H+ + PO43– K3 = 
Очевидно, что диссоциации H2PO4–соответствует вторая константа диссоциации ортофосфорной кислоты, поэтому на нее и следует разделить KWприрасчете константы гидролиза:
Кгидр.=  =
= 
Какую реакцию имеет раствор этой соли?
Ясно, что за счет гидролиза этой соли раствор подщелачивается (см. ионное уравнение). В то же время гидрофосфат-ионы могут участвовать и в другом равновесии – диссоциации по кислотному типу:
HPO42–  H+ + PO43– K3 =
H+ + PO43– K3 = 
За счет этой реакции раствор подкисляется. Для того чтобы определить результат этих конкурирующих равновесий необходимо сравнить их константы, Кгидр = 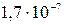 и K3 =
и K3 =  : Кгидр > K3, поэтому [OH–] > [H+], и раствор будет щелочным, т.е. его pH > 7.
: Кгидр > K3, поэтому [OH–] > [H+], и раствор будет щелочным, т.е. его pH > 7.
Расчет материального баланса равновесия гидролиза. Степень гидролиза.
Степень гидролиза (h) показывает, какая часть растворенной соли прогидролизовалась: h = 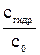 , (7.7)
, (7.7)
где сгидр. – концентрация, прогидролизовавшейся соли, с0 – начальная ее концентрация, моль/л. В уравнении (7.7) вместо молярности может быть химическое количество вещества или число частиц.
Связь степени гидролиза с константой гидролиза выводится подобно тому, как это было показано ранее для степени диссоциации слабых электролитов  (см. тему 6).
(см. тему 6).
Например, для расчета степени гидролиза соли слабой одноосновной кислоты KNO2 в растворе с концентрацией с0 моль/л:
– Напишем сокращенное ионно-молекулярное уравнение гидролиза и рассчитаем Кгидр.: KNO2  K+ + NO2–
K+ + NO2–
NO2– + HOH  HNO2 + OH–
HNO2 + OH–
Kгидр. = 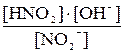 =
= 
Из уравнения (7.7): сгидр. = с0×h;
из ионного уравнения гидролиза видно, что
сгидр. = [HNO2] = [OH–] = с0×h
Подставив эти соотношения в выражение константы гидролиза, получим следующее уравнение:
Kгидр. = 
 (7.8)
(7.8)
Решая полученное уравнение относительно h, определим затем [HNO2] = [OH–] = С0×h, а также [HNO2] = (C0 – С0×h), моль/л.
Уравнение (7.8) можно упростить: если h << 1 (при Kгидр./с0  10–2), то можно считать, что (1 – h) » 1; тогда Kгидр. = с0 h2, и
10–2), то можно считать, что (1 – h) » 1; тогда Kгидр. = с0 h2, и
 .=
.=  (7.8–а)
(7.8–а)
Таким образом, степень гидролиза зависит от природы соли (через Kгидр) и обратно пропорциональна корню квадратному из молярной ее концентрации.
Если необходимо определить только равновесные концентрации продуктов гидролиза, без степени гидролиза, то расчет можно выполнить общим способом материального баланса в равновесной системе:
Обозначим:
концентрацию прогидролизовавшейся соли сгидр. = х моль/л;
равновесную (негидролизованную) часть соли (с0 – x), моль/л; равновесную концентрацию продуктов гидролиза [HNO2] = [OH–] = сгидр. = x. моль/л;
Подставив эти соотношения в выражение константы гидролиза, получим следующее уравнение:
Kгидр. = 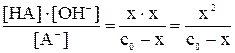
Решая полученное уравнение относительно x, определим [HNO2] = [OH–] = x, а также [HNO2] = (с0 – x), моль/л.
Если h << 1 (при Kгидр./с0  10–2), то в полученном уравнении можно считать, что (1 – х) » 1; тогда Kгидр. = с0 х2, и
10–2), то в полученном уравнении можно считать, что (1 – х) » 1; тогда Kгидр. = с0 х2, и
х = [OH–] = [HNO2] =  =
= 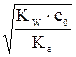
Пример: Рассчитать степень гидролиза и pH в растворе нитрита калия при C0(KNO2) = 0,1 моль/л.
Решение: Уравнение диссоциации соли KNO2  K+ + NO2–
K+ + NO2–
Уравнение гидролиза NO2– + HOH  HNO2 + OH–
HNO2 + OH–
Kгидр. = 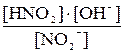 =
= 
Проверим возможность использования упрощенного расчета:  < 10–2 – упрощенный расчет возможен:
< 10–2 – упрощенный расчет возможен:
 =
= 
[HNO2] = [OH–] =  h = 0,1×1,3×10–6 = 1,3×10–7 моль/л.
h = 0,1×1,3×10–6 = 1,3×10–7 моль/л.
pOH = 6,89; pH = 7,11
Смещение равновесий гидролиза
(усиление и подавление гидролиза), влияние pH
В соответствии с принципом Ле Шателье равновесие гидролиза, например NO2– + HOH  HNO2 + OH– можно изменить, если изменить температуру или концентрации веществ, участвующих в равновесии. Вследствие того, что изменение давления практически не влияет на объем жидких растворов, равновесие гидролиза практически не зависит от давления (а если продуктами гидролиза оказываются газообразные вещества?)
HNO2 + OH– можно изменить, если изменить температуру или концентрации веществ, участвующих в равновесии. Вследствие того, что изменение давления практически не влияет на объем жидких растворов, равновесие гидролиза практически не зависит от давления (а если продуктами гидролиза оказываются газообразные вещества?)
Гидролиз – процесс в большинстве случаев эндотермический, поэтому при увеличении температуры равновесие смещается вправо (степень гидролиза и концентрация продуктов в растворе увеличиваются); при охлаждении раствора равновесие смещается в обратном направлении. Для некоторых солей этот способ смещения равновесия отчетливо проявляется опытным путем: так, при кипячении раствора хлорида железа(III) из него выделяется осадок гидроксида.
При увеличении концентрации соли равновесие смещается в прямом направлении (концентрация продуктов увеличивается, но степень гидролиза уменьшается – см. уравнение 7.8–а).
Однако самый эффективный способ усиления или подавления гидролиза основан на том, что наиболее широкий диапазон изменения концентраций в водных растворах возможен для ионов водорода и гидроксид-ионов, участвующих в равновесии (вспомните KW = 10–14). Так, например, нитриты щелочных металлов в водном растворе устойчивы вплоть до температуры кипения (степень гидролиза при этом увеличивается, но не существенно). Однако при подкислении этих растворов нитриты можно разложить практически полностью: NO2– + HOH  HNO2 + OH– – добавленные ионы водорода (гидроксония) связываются с гидроксид-ионами, и равновесие смещается вправо, степень гидролиза соли увеличится. При добавлении щелочи равновесие сместится влево, степень гидролиза уменьшится.
HNO2 + OH– – добавленные ионы водорода (гидроксония) связываются с гидроксид-ионами, и равновесие смещается вправо, степень гидролиза соли увеличится. При добавлении щелочи равновесие сместится влево, степень гидролиза уменьшится.
Применение гидролиза в синтезе и анализе
Различные варианты гидролиза солей особенно необратимого, могут быть использованы в неорганическом синтезе и анализе. Например, гидролизом Al2S3 удобно получать сероводород в лаборатории; действием соды на растворы солей алюминия (взаимное усиление гидролиза) – гидроксиды алюминия, хрома(III) и др. Вследствие того, что в результате гидролиза растворы часто становятся кислыми или щелочными, это можно использовать для различия солей. Например, легко различить растворы сульфата натрия (pH = 7) и его карбоната (pH > 7); фосфата калия (pH > 7) и его дигидрофосфата (pH < 7) и др. Выделение осадков или газов при необратимом гидролизе также можно использовать для качественных реакций. Так, нитраты и нитриты легко различить действием на них не только кислотами, но, например, раствором соли алюминия: в результате взаимного усиления гидролиза нитриты образуют нестойкую азотистую кислоту, при разложении которой выделяется бурый оксид азота (IV).
Гидролиз также широко применяется в органическом синтезе и анализе, в химических технологиях, включая производства химволокон, о чем Вы узнаете при изучении последующих дисциплин.
8 Гетерогенные равновесия в растворах электролитов.
Произведение растворимости
Растворимость разных по природе веществ
Дата добавления: 2020-07-18; просмотров: 560;











