Константа химического равновесия
Реакции, которые могут одновременно протекать в прямом и обратном направлениях, называются обратимыми. Состояние системы, когда скорость прямой реакции 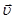 равна скорости обратной реакции
равна скорости обратной реакции 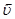 , называется химическим равновесием. Химическое равновесие имеет динамический характер, то есть за определенный промежуток времени в определенном объеме реакционного пространства по прямой реакции образуется столько продукта, сколько и разлагается его по обратной реакции.
, называется химическим равновесием. Химическое равновесие имеет динамический характер, то есть за определенный промежуток времени в определенном объеме реакционного пространства по прямой реакции образуется столько продукта, сколько и разлагается его по обратной реакции.
Для гомогенной реакции, находящейся в состоянии равновесия,
аА + вВ « dD + mM
будет выполняться соотношение
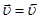 или
или 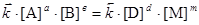 ,
,
где 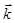 ,
, 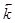 - константы скорости прямой и обратной реакций; [A], [B], [D], [M] – концентрации участников реакции, установившиеся к моменту равновесия, иначе равновесные концентрации. Из уравнения следует, что
- константы скорости прямой и обратной реакций; [A], [B], [D], [M] – концентрации участников реакции, установившиеся к моменту равновесия, иначе равновесные концентрации. Из уравнения следует, что
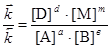 .
.
Соотношение констант 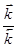 при постоянной температуре является постоянной величиной для данной реакции и называется константа химического равновесия К. Таким образом, связь между константой равновесия и равновесными концентрациями будет отражаться формулой
при постоянной температуре является постоянной величиной для данной реакции и называется константа химического равновесия К. Таким образом, связь между константой равновесия и равновесными концентрациями будет отражаться формулой
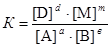 .
.
Это уравнение является вариантом математической записи закона действующих масс для химического равновесия: при постоянной температуре отношение произведения равновесных концентраций продуктов реакции в степенях, равных стехиометрическим коэффициентам, к произведению равновесных концентраций исходных веществ в степенях, равных стехиометрическим коэффициентам, является величиной постоянной.
Если все участники реакции являются газообразными веществами, то вместо равновесных концентраций удобнее пользоваться равновесными парциальными давлениями компонентов РА, РВ, РDи РM, тогда закон действующих масс пример вид 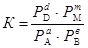 .
.
Для гетерогенных реакций закон действующих масс выполняется при условии, что в уравнения констант равновесия не входят равновесные концентрации (парциальные давления) твердых исходных веществ и продуктов реакции. Например, для гетерогенной реакции
Сграфит + 2Н2Огаз « СО2 + 2Н2
константа равновесия выражается уравнением
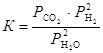 .
.
Константа химического равновесия зависит от природы реагирующих веществ и от температуры. Влияние температуры на К определяется знаком теплового эффекта реакции. Для эндотермической реакции (Q < 0) при повышении температуры константа равновесия увеличивается, и наоборот, для экзотермической реакции (Q > 0) при возрастании температуры К уменьшается. Строгую связь между температурой и константой равновесия реакции, протекающей при постоянном давлении, отражает уравнение изобары Вант-Гоффа
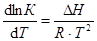 ,
,
где lnК – натуральный логарифм константы равновесия; DН – изменение энтальпии реакции; R – универсальная газовая постоянная; Т –абсолютная температура, К. Из уравнения видно, что при увеличении абсолютного значения энтальпии реакции и уменьшении температуры чувствительность К к изменению температуры повышается. Используя уравнение изобары Вант-Гоффа, можно вывести формулу для расчета среднего значения DН реакции, если известны значения константы равновесия при двух температурах
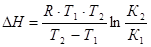 ,
,
где К1, К2 – константы равновесия реакции при температурах Т1 и Т2 соответственно.
Пример 1. В состоянии равновесия для реакции N2 + 3H2 « 2NH3 концентрации участников реакции равны (моль/дм3): [N2] = 3; [H2] = 9; [NH3] = 4. Вычислите константу равновесия реакции и определите исходные концентрации азота и водорода, полагая, что до начала реакции аммиак в системе отсутствовал.
Р е ш е н и е
Данная реакция является гомогенной, поэтому константа равновесия равна
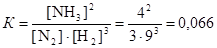
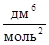 .
.
Из уравнения реакции следует, что для образования 4 моль продукта требуется 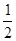 × 4 = 2 моль азота и
× 4 = 2 моль азота и 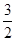 × 4 = 6 моль водорода. Следовательно, исходная концентрация азота составляет [N2]0 = 3 + 2 = 5 моль/дм3, а исходная концентрация водорода равна [H2]0 = 9 + 6 = 15 моль/дм3.
× 4 = 6 моль водорода. Следовательно, исходная концентрация азота составляет [N2]0 = 3 + 2 = 5 моль/дм3, а исходная концентрация водорода равна [H2]0 = 9 + 6 = 15 моль/дм3.
Пример 2. Константа равновесия реакции FeOтв + СО « Feтв + СО2 при некоторой температуре равна 0,5. Определите равновесные концентрации газов, если до начала реакции газовая смесь содержала 0,05 моль/дм3 СО и 0,01 моль/дм3 СО2.
Р е ш е н и е
Для данной гетерогенной реакции константа равновесия определяется выражением 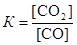 . Пусть к моменту равновесия в реакцию вступило х моль СО. Тогда, согласно уравнению реакции, образовалось столько же моль СО2. Следовательно, равновесные концентрации газов будут равны: [CO] = (0,05 – х) моль/дм3; [CO2] = (0,01 + х). Подставим эти концентрации в выражение для константы равновесия
. Пусть к моменту равновесия в реакцию вступило х моль СО. Тогда, согласно уравнению реакции, образовалось столько же моль СО2. Следовательно, равновесные концентрации газов будут равны: [CO] = (0,05 – х) моль/дм3; [CO2] = (0,01 + х). Подставим эти концентрации в выражение для константы равновесия
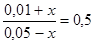 или
или 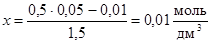 .
.
Таким образом, [CO] = 0,05 – 0,01 = 0,04 моль/дм3;
[CO2] = 0,01 + 0,01 = 0,02 моль/дм3.
Пример 3. Константа равновесия реакции Н2 + I2 « 2HI равна 64,8. Определите равновесные концентрации компонентов, если исходная смесь содержала 1,4 моль/дм3 водорода и 1,0 моль/дм3 йода.
Р е ш е н и е
Выражение для константы равновесия имеет вид
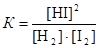 .
.
Пусть к моменту равновесия образовалось х моль HI. Тогда, согласно уравнению реакции, было израсходовано по 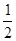 х моль йода и водорода. Следовательно, можно составить уравнение
х моль йода и водорода. Следовательно, можно составить уравнение
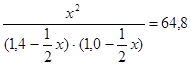 или 15,2 х2 – 77,76 х + 90,72 = 0.
или 15,2 х2 – 77,76 х + 90,72 = 0.
Решение данного квадратного уравнения даст корни: х1 = 3,32 моль/дм3;
х2 = 1,8 моль/дм3. Первый корень не удовлетворяет условию задачи по физическому смыслу (концентрация HI не может быть больше, чем удвоенная концентрация йода или водорода, то есть 2 или 2,8 моль/дм3). Таким образом, используем второй корень уравнения. Равновесные концентрации компонентов равны (моль/дм3):
[HI] = 1,8; [H2] = 1,4 - 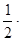 1,8 = 0,5; [I2] = 1,0 -
1,8 = 0,5; [I2] = 1,0 - 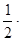 1,8 = 0,1.
1,8 = 0,1.
Пример 4.Вычислите константу равновесия реакции 2СО « Ств + О2, если известны значения констант равновесия реакций:
1) СО2 « Ств + О2 , К1 = 1,8×10-21;
2) 2СО2 « 2СО + О2 , К2 = 2×10-5 .
Р е ш е н и е
Запишем выражение для искомой константы равновесия 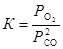 . Равновесное парциальное давление СО выразим из константы равновесия второй реакции
. Равновесное парциальное давление СО выразим из константы равновесия второй реакции
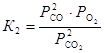 , откуда
, откуда 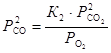 .
.
Тогда, 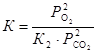 . Соотношение равновесных парциальных давлений кислорода и оксида углерода (IV) найдем из выражения для константы равновесия первой реакции
. Соотношение равновесных парциальных давлений кислорода и оксида углерода (IV) найдем из выражения для константы равновесия первой реакции 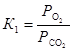 . Следовательно
. Следовательно
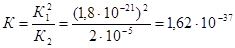 .
.
Пример 5.Константа равновесия некоторой реакции при 298 К равна 12,3 дм3/моль, а при 350 К - 1,07 дм3/моль. Вычислите изменение энтальпии реакции в данном интервале температур.
Р е ш е н и е
Используем уравнение изобары Вант-Гоффа
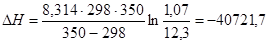 Дж/моль.
Дж/моль.
Дата добавления: 2018-11-26; просмотров: 931;











