Смещение химического равновесия
В целях более полного превращения исходных веществ в продукты, довольно часто возникает необходимость смешения равновесия в сторону прямой реакции. Этого можно достигнуть путем изменения условий протекания реакции. Переход реакционной системы из одного равновесного состояния к другому называют смещением химического равновесия.
При изменении условий проведения реакции смещение химического равновесия в сторону прямой или обратной реакции происходит в соответствии с принципом Ле Шателье: если в равновесной смеси изменить концентрацию одного из реагирующих веществ, температуру или давление, то равновесие смещается в направлении той реакции (прямой или обратной), которая ослабляет эффект от данного воздействия на равновесную систему.
Влияние концентраций (парциальных давлений) компонентов на сдвиг равновесия. При повышении концентрации исходного вещества ускоряется прямая реакция, что приводит к росту концентраций продуктов и уменьшению концентраций исходных веществ, то есть смешению равновесия в сторону прямой реакции (вправо). И, наоборот, при увеличении концентрации продукта реакции равновесие смещается в сторону обратного процесса (влево). Для гетерогенного равновесия изменение концентраций твердых фаз не влияет на сдвиг равновесия.
Влияние температуры на сдвиг равновесия. С увеличением температуры равновесие смещается в сторону того процесса, который идет с поглощением тепла, то есть в сторону эндотермической реакции.
Влияние общего давления на сдвиг равновесия. Изменение общего давления влияет на равновесие только для тех реакций, которые протекают с изменением числа моль газообразных веществ. В соответствии с принципом Ле Шателье увеличение общего давления в системе смещает равновесие в том направлении, где происходит уменьшение числа моль газов.
Пример 1.Какие меры можно предпринять для повышения выхода продукта реакции N2 + 3H2 « 2NH3, DН 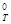 = -92,4
= -92,4 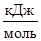 .
.
Р е ш е н и е
По условию задачи требуется сместить равновесие в сторону прямой реакции, поэтому следует:
1) увеличивать концентрации азота и водорода, то есть постоянно водить в систему свежие порции реагентов;
2) уменьшать концентрацию аммиака, иначе выводить его из реакционного пространства;
3) понижать температуру, так как прямая реакция является экзотермической;
4) увеличивать давление (уменьшать объем), потому что в прямом направлении происходит уменьшение числа моль газообразных веществ (из 4 моль газа образуется 2 моль газа).
Пример 2. Как изменится равновесная концентрация кислорода, если в системе 2Ств + О2 « 2СО при постоянной температуре увеличить концентрацию СО в 3 раза?
Р е ш е н и е
Запишем выражение для константы равновесия данного гетерогенного процесса 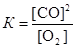 . По условию задачи
. По условию задачи 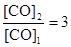 . Поскольку константа равновесия не зависит от концентраций реагентов, то должно выполняться равенство
. Поскольку константа равновесия не зависит от концентраций реагентов, то должно выполняться равенство
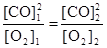 или
или 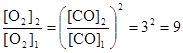 .
.
Таким образом, при повышении концентрации СО в 3 раза равновесная концентрация кислорода должна увеличится в 9 раз.
З а д а ч и
1. В каком направлении сместится химическое равновесие в системе 2NO2 « 2NO + O2, если равновесные концентрации каждого компонента уменьшить в 3 раза?
2. Как надо изменить давление в равновесной системе 2СО + О2 « 2СО2, чтобы сместить равновесие в сторону прямого процесса?
3. В каких обратимых реакциях изменение давления не вызовет нарушения равновесия и почему:
2SO2 + O2 « 2SO3;
4HCl + O2 « 2H2O + 2Cl2;
MgCO3, тв « MgOтв + CO2;
H2 + I2 « 2HI.
4. В каком направлении сместится равновесие обратимого процесса COCl2 « СО + Cl2, если концентрацию каждого из веществ увеличить в 2 раза?
5. Как повлияет изменение давления и температуры на равновесие следующих обратимых реакций:
2СО « СО2 + Ств , DН 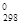 = -172,5 кДж/моль;
= -172,5 кДж/моль;
2H2S « 2H2 + S2, тв , DН  = +169,4 кДж/моль;
= +169,4 кДж/моль;
2HBr « H2 + Br2 , DН 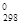 = +72,5 кДж/моль.
= +72,5 кДж/моль.
6. В каком направлении сместится равновесие для обратимой реакции Ств + Н2Огаз « СО + Н2 при уменьшении объема системы в 2 раза.
7. Какие меры следует предпринять для увеличения выхода монооксида углерода в обратимом процессе 2СО « СО2 + Ств , DН 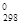 = -172,5 кДж/моль?
= -172,5 кДж/моль?
8. При повышении температуры равновесное давление кислорода над оксидом железа (II) возрастает. Укажите знак теплового эффекта реакции FeOтв « Feтв + 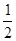 О2.
О2.
9. Обсудите влияние изменения давления на возможность протекания реакции обжига сульфида меди (II)
2CuSтв + 3О2 « 2CuOтв + 2SO2.
10. При окислении аммиака кислородом возможно образование азота и различных оксидов азота. Напишите уравнения и обсудите влияние давления на сдвиг равновесия реакций с образованием а) N2O и б) NO.
11. Как изменится равновесная концентрация исходного вещества для обратимого процесса COCl2 « СО + Cl2, если концентрацию каждого из продуктов увеличить в 2 раза?
12. Какие условия следует указать, чтобы ответить на вопрос, в какую сторону смещается равновесие в системе, содержащей газы N2, O2, NO?
13. Обсудите влияние давления на равновесие реакции образования оксида азота (IV) из простых веществ.
14. При повышении температуры равновесное давление СО2 над карбонатом некоторого двухвалентного металла уменьшается. Запишите реакции разложения карбоната металла и укажите знак теплового эффекта реакции.
15. Равновесная газовая система состоит из веществ SO2, O2, SO3. Каких веществ в системе станет больше при увеличении давления?
16. Смесь газов NH3, Cl2, N2, HCl находится в равновесии. У каких веществ концентрация возрастет при уменьшении общего давления в системе?
17.Взаимодействие твердого углерода с водяным паром происходит по уравнениям
Н2О + С « СО + Н2 – Q;
2Н2О + С « СО2 + 2Н2 – Q.
Каковы физические условия получения газовых смесей с максимальным содержанием продуктов реакций?
18. При повышении температуры раствора растворимость сахара в воде увеличивается. Укажите знак изменения энтальпии в процессе растворения сахара.
19. При растворении соли в воде температура раствора уменьшается. Что можно сказать о влиянии температуры на растворимость соли?
20. Во сколько раз изменится равновесное парциальное давление аммиака в процессе N2 + 3H2 « 2NH3, если увеличить давление азота в 4 раза?
21. Во сколько раз изменится равновесное парциальное давление водорода в процессе N2 + 3H2 « 2NH3, если увеличить давление азота в 2 раза?
22. При повышении температуры равновесное давление кислорода над оксидом железа (III) возрастает. Укажите знак теплового эффекта реакции Fe2O3, тв « 2Feтв + 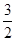 О2.
О2.
23. В каких обратимых реакциях повышение давления вызовет смещение равновесия вправо и почему:
2SO2 + O2 « 2SO3; 4HCl + O2 « 2H2O + 2Cl2;
СаCO3, тв « СаOтв + CO2; H2 + Br2 « 2HBr.
24. При окислении аммиака кислородом возможно образование азота и различных оксидов азота. Напишите уравнения и обсудите влияние давления на сдвиг равновесия реакций с образованием а) N2O3 и б) NO2.
25. Горение твердого углерода происходит по уравнениям
О2 + 2С « 2СО + Q; О2 + С « СО2 + Q.
Каковы физические условия для обеспечения наиболее полного сжигания топлива?
Литература
1. Угай Я.А. Общая и неорганическая химия. М.: Высш. шк., 1997.
2. Ахметов Н.С. Общая и неорганическая химия. М.: Высш. шк., 1998.
3. Коровин Н.В. Общая химия. М.: Высш. шк., 1998.
4. Гольбрайх З.Е., Маслов Е.И. Сборник задач и упражнений по химии. М.: Высш. шк., 1997.
5. Лидин Р.А., Молочко В.А., Андреева Л.Л. Задачи по неорганической химии. М.: Высш. шк., 1990.
6. Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач и упражнений по общей химии. М.: Высш. шк., 1991.
7. Коршунов Б.Г., Стефанюк С.Л. и др. Задачник по общей химии для металлургов. М.: Высш. шк., 1977.
8. Зайцев О.С. Познавательные задачи по общей химии. М.: Изд-во Моск. ун-та, 1982.
9. Михилев Л.А., Пассет Н.Ф., Федотова М.И. Задачи и упражнения по неорганической химии. СПб: Химия, 1995.
Дата добавления: 2018-11-26; просмотров: 946;











