ЗАКОН ГЕССА. РАСЧЕТ ТЕПЛОПРОИЗВОДИТЕЛЬНОСТИ ТОПЛИВА. ЗАВИСИМОСТЬ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ КИРХГОФА
ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ. ПРОЦЕССЫ ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ПРИ ПОСТОЯННОМ
ОБЪЕМЕ
Пример 1. Рассчитайте разницу между тепловыми эффектами при постоянном давлении и постоянном объеме (Qp — Qv ) реакции
С2 H4 0(г) + H2 (г) =C2 Н5 0Н(Ж) , протекающей при 298 К. Чему равна эта разница, если температуру повысить до 400 К и спирт перевести в газообразное состояние?
Решение. 1-й закон термодинамики можно выразить уравнением
ΔU = Q - Aмех
где ΔU - изменение внутренней энергии системы (U2-U1) при переходе системы из состояния "1" в состояние “2"; Q — теплота; Aмех - работа механическая, равная рΔV, где р - давление, а ΔV- изменение объема (V2-V1).
Тепловой эффект процесса, протекающего при р=const
Qp= ΔH = ΔU+pΔ , (1.2)
где ΔH - изменение энтальпии.
Тепловой эффект процесса, протекающего при р = const
Qp-Qv=pΔV=ΔnRT,
где R - газовая постоянная = 8,3144 Дж/моль *К; Δn=n2-n1 ; n1 и n2 - количество молей реагентов и продуктов реакции газообразных веществ; T - температура, К.
Отсюда: 1) при 298 К Qр - Qv = ΔnRT = (0-2) 8,3144-298 = -4955,38 Дж;
2) при 400 К и газообразном С2Н5ОН Qp – Qv = (1-2) 8,3144-400 = -3325,76 Дж.
Ответ при 298 К Qp-Qv = -4955,38 Дж; при 400°К Qp - Qv= -3325,76 Дж.
Пример 2. Определить стандартную энтальпию образования
ацетилена по энергиям связей отдельных его атомов:
2С(гр) + H2 → C2H2 ; Δ Hообр .
Решение. Стандартная энтальпия (теплота) образованиям Δ Hообр - тепло, поглощенное или выделенное в процессе синтеза 1 моля соединения из простых веществ при условии, что все компоненты системы находятся в стандартных состояниях.
Верхний индекс Δ Hо здесь и в последующих случаях Δ Gо, Δ Sо, Δ Fо обозначает, что реагирующие вещества находятся в своих стандартных состояниях. Стандартное состояние для газов - это состояние идеального газа при давлении 1 атм (101330 Па) и определенной температуре. Для жидкости - это состояние чистой жидкости, а для твердых веществ — это кристаллическое состояние при тех же условиях. Строго говоря, температура должна быть точно указана в виде индекса.
Например, Δ Hо 273 , однако, если не оговорено, то стандартное состояние относится к 298 К. Образование молекулы ацетилена Н – С ≡С- Н сопровождается образованием двух связей Н - С (358,2 кДж/моль) и одной связи С ≡ С (536 кДж/моль); разрушением связи H – H (430 кДж/моль) и переходом 2C(rp) → 2-С(г) (525 кДж/моль).
Образование связи сопровождается выделением энергии, разрушение - поглощением.
Δ Hообр C2H2 = (-358,2*2)+(-536)+430+525*2=227,6 кДж/моль.
Ответ.Δ Hообр C2H2 = 227,6 кДж/моль.
ЗАКОН ГЕССА. РАСЧЕТ ТЕПЛОПРОИЗВОДИТЕЛЬНОСТИ ТОПЛИВА. ЗАВИСИМОСТЬ ТЕПЛОВОГО ЭФФЕКТА РЕАКЦИИ ОТ ТЕМПЕРАТУРЫ. УРАВНЕНИЕ КИРХГОФА
Пример 1. Определить при 298 К тепловой эффект (ΔH°) реакции
Al2O3(кр) + ЗSO3(г)= Al2(SO4)3(кр) ; ΔH° .
Решение. Если ΔH реакции > О - реакция эндотермическая, идет с поглощением тепла; если ΔH реакции < О - реакция экзотермическая, идет с выделением тепла. По следствию из закона Гесса имеем: тепловой эффект реакции ΔH° равен разности между суммой стандартных энтальпий (теплот) образования Δ Hообр продуктов реакции и реагентов с учетом их стехиометрических коэффициентов νj, νi) :
продукты реагенты
δη°=ς vj Δ Hообр - ς νi Δ Hообр . (2.1)
Из табл. 3 выпишем значения стандартных энтальпий образования:
Δ Hо298 Al2O3(кр) = -1672 кДж/моль;
Δ Hо298 SO3(г) =-395,7 кДж/моль;
Δ Hо298 A12(S04)3(кр)= -3439,0 кДж/моль.
Тепловой эффект реакции находим по (1.2.1):
Δ Hо= Δ Hо298 A12(S04)3 - Δ Hо298 Al2O3-3 Δ Hо298 SO3 =
= -3439,0+1672+3*395,7 = -580,8 кДж
Ответ ΔΗ°=-580,8 кДж.
Пример 2. Определить тепловой эффект ΔΗ° реакции этерификации щавелевой кислоты метиловым спиртом, протекающей по уравнению
(СООН)2+ 2СН3 ОН—> (соосн3)2 + 2Н2О ,
если стандартные энтальпии сгорания (см. табл. 5)
ΔHocгop(COOН)2 = -251,8 кДж/моль;
ΔHocгop (СН3ОН) = -727,59 кДж/моль;
ΔHocгop (COOCН3)2= -168О,19 кДж/моль.
Решение. По следствию из закона Гесса имеем: тепловой эффект реакции равен разности между суммой энтальпий сгорания реагентов и суммой энтальпий сгорания конечных продуктов с учетом их стехиометрических коэффициентов:
реагенты продукты
ΔHo=Σ νi ΔHocгop - Σ νj ΔHocгop (1.2.2)
Следовательно,
ΔHo = ΔHocгop(COOН)2 + 2 ΔHocгop (СН3ОН) - 2 ΔHocгop (COOCН3)2 - 2 ΔHocгop (H2O)= - 251,8 - (2*727,59)+1680,19 = -26,79 кДж.
Энтальпия сгорания Н20 (а также CO2 ) равны нулю.
Ответ. ΔHo = -26,79 кДж.
Пример 3. Определить стандартную энтальпию образования (Δ Hо298 обр) этилена, если тепловой эффект реакции горения этилена равен - 1412,99 кДж/моль, а стандартные энтальпии образования (Δ Hо298 обр) CО2 и H2O(ж) равны соответственно - 394,07 и - 286,26 кДж/моль.
Решение. Горение этилена происходит по реакции
C2H4(г) + 3О2 = 2СО2(г) + 2Н2О(ж);
ΔΗ = -1412,99 кДж/моль
По следствию из закона Гесса (1.2.1):
Δ Hо =2Δ Hо298 Н2О + 2Δ Hо298 СО2 - Δ Hо298 С2Н4 - Δ Hо298 О2
Стандартные энтальпии образования простых веществ равны нулю, отсюда Δ Hо298 О2= 0. Тогда
Δ Hо298 C2H4 = 2Δ Hо298 H20 +2Δ Hо298 CO2 - Δ Hо =-(2*286,26)- (2*394,07) +1412,99 = -572,52-788,14+ +1412,99 = 52,3 кДж/моль.
Ответ. Δ Hо298 C2H4 = 52,3 кДж/моль.
Пример 4. Рассчитать теплотворную способность метана. Реакция горения метана протекает по уравнению
СН4 + 2O2 =СО2 + 2H2O;Δ Hо.
ΔHocгop метана равна -891,63 кДж/моль.
Решение. Теплотворной способностью топлива называется количество тепла, выделяющееся при сгорании одного килограмма топлива (топливо состоит из горючего и окислителя).
По формуле (1.2.2) имеем
ΔΗ°= ΔHocгop CH4 + ΔHocгop O2 - ΔHocгop CO2 - ΔHocгop H2O;
ΔHocгop для O2, Н2O и СO2 равны нулю,
Поэтому ΔΗ0= ΔHocгop CH4 = -891,632 кДж/моль. Это количество тепла выделяется при сгорании 80 г топлива (вес 1-го моля метана и 2-х молей кислорода). Следовательно, теплотворная способность метана
Т.С. = (891,632/80)*1000=1114,54кДж/кг
Ответ. т.С. метана равна 1114,54 кДж/кг.
Пример 5. Определить тепловой эффект реакции
CH3OH(г) + 3/2O2=CO2(г) + 2H2O(г) при 500К и 1013 гПа
Решение. Зависимость теплового эффекта реакции от температуры выражается уравнением Кирхгофа (если в данном процессе отсутствуют фазовые превращения)
ΔΗΤ = ΔΗ0Т0 + 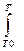 ΔС°р dT,(2.3)
ΔС°р dT,(2.3)
где ΔС°р -разность сумм молярных изобарных теплоемкостей продуктов реакций и реагентов с учетом их стехиометрических коэффициентов. Приняв, что ΔС°р не зависит от температуры в данном температурном интервале(T0 до T), уравнение (2.3) запишем в виде
ΔΗт= ΔΗ0Т0 + ΔС°р (Т-Т0). (2.4)
Для решения этого уравнения необходимо знать тепловой эффект реакции при какой-либо температуре Т0. Удобно воспользоваться тепловым эффектом, вычисленным по закону Гесса- при Т0=298 К. Стандартные энтальпии образования компонентов берем из табл. 3. По формуле (2.1)
Δ Hо298= Δ Hо298 CO2 + 2Δ Hо298 H2O - Δ Hо298 CH3OH(г) -3/2 Δ Hо298 O2=
=-394-(2*241,8)-(-201,2)-0=-676,4 кДж.
Далее находим ΔС°рпо табличным значениям Ср (табл.4):
ΔС°р= С°р CO2 + 2 С°рH2O - С°рCH3OH -3/2 ΔС°рO2=
37,13+2.33ι56-43,9-3/2·(29,36)=16>31 Дж/моль*К =
= 16,31·10-3 кДж/моль*К, отсюда по формуле (1.2.4)
δΗ°500 = -676,4+16,31·10-3(500-298) = -676,4 + 3,29 = -673,11 кДж.
Ответ. δΗ°500 = -673,11 кДж.
| <== предыдущая лекция | | | следующая лекция ==> |
| СИСТЕМА МЕРОПРИЯТИЙ ПО ЗАЩИТЕ ПЛОДОВЫХ КУЛЬТУР ОТ ВРЕДИТЕЛЕЙ, БОЛЕЗНЕЙ И СОРНЯКОВ | | | КОНЦЕНТРАЦИЯ РАСТВОРОВ. ТИТРОВАНИЕ |
Дата добавления: 2020-04-12; просмотров: 1197;











