II закон термодинамики. Теорема Карно-Клаузиуса
Задачей второго закона термодинамики является определение условий, в которых возможно протекание самопроизвольных процессов, и условий, при которых наступает равновесие.
Коэффициент полезного действия (кпд) тепловой машины, работающей по квазистатическому циклу Карно, не зависит от природы рабочего тела, а определяется только интервалом температур, в котором совершается работа. Справедливость этой посылки в термодинамике доказывает теорема Карно-Клаузиуса, являющаяся одной из формулировок II закона термодинамики:
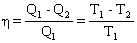 , где: Q1 – теплота, сообщенная рабочему телу при температуре Т1 от источника тепла; Q1 – теплота, отданная телом при температуре Т2 холодильнику.
, где: Q1 – теплота, сообщенная рабочему телу при температуре Т1 от источника тепла; Q1 – теплота, отданная телом при температуре Т2 холодильнику.
Основной формулировкой второго закона является формулировка Больцмана: «Все процессы в природе переводят систему из состояния менее вероятного в более вероятное».
В 1865 г. Клаузиус ввел новую функцию состояния S – энтропию, являющуюся мерой хаоса, неупорядоченности системы, которая принята в качестве меры вероятности: 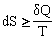 (математическая запись второго начала).
(математическая запись второго начала).
Второе начало имеет статистическую интерпретацию: S=k*ln(w) (формула Больцмана), где: k= 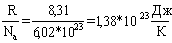 – константа Больцмана, w – термодинамическая вероятность (или статистический вес) макросостояния.
– константа Больцмана, w – термодинамическая вероятность (или статистический вес) макросостояния.
Величина, равная dQ/T, называется приведенным теплом и является рассеянной теплотой, следовательно и энтропия характеризует рассеянность теплоты; размерность ее соответствует [Дж/моль×К]. В изолированной системе (Q=0) приращение энтропии при равновесии равно приведенному теплу, а в самопроизвольных процессах больше приведенной теплоты. Энтропия является функцией состояния системы и однозначно определяется ее параметрами.
III закон термодинамики. Теорема Нернста. Постулат Планка
Важное значение в раскрытии этого закона принадлежит работам Нернста и Ричардса. В частности, Нернст в 1906г. в своей классической работе «О вычислении химического равновесия из термических данных» высказал гипотезу, суть которой эквивалентна следующему утверждению:
при Т®0 S=0 и dS=0. Важнейшим следствием этой гипотезы является то, что энтропия правильно сформированного (бездефектного) идеального кристалла при 0К равна 0. Этот постулат впервые сформулировал Планк в 1912г. По сути, это и есть формулировка третьего начала (закона) термодинамики: limT®0S=0; ST=òс(T)dT/T.
На основе этого закона разработаны современные методы вычислений изменения стандартной энергии Гиббса, а также констант равновесия при различных температурах.
Дата добавления: 2020-10-14; просмотров: 916;











