Свойства расплавленных электролитов
Многие расплавленные соединения (соли и гидроксиды) хорошо проводят электрический ток, являясь проводниками 2-го рода — электролитами.
Электролиз расплавленных сред подчиняется в основном тем же законам, что и электролиз водных растворов.
Важную роль при электролизе расплавленных сред играет поддержание необходимой температуры расплава. Излишнее повышение температуры вызывает ряд затруднений (усиливается растворимость выделившегося металла, его испарение и др.). Поэтому желательно поддерживать наиболее низкую температуру электролиза. Однако температура электролита должна быть выше температуры плавления выделяемого металла (кроме тугоплавких металлов), чтобы его легко можно было удалить из электролизера; должна быть исключена возможность застывания электролита, так как это нарушает процесс. Так как температура плавления солей, содержащих выделяемый металл, высока {например, А12О3 — более 2000 °С), то при электролизе применяют смеси солей, что понижает температуру плавления, увеличивает его электропроводность, понижает вязкость и снижает растворимость металла в расплаве.
Расплав электролита должен быть таким, чтобы его плотность была больше плотности выделяемого металла, если металл должен собираться на поверхности электролита (например, Mg, Na) и, наоборот, если он собирается под электролитом (например, А1).
При электролизе расплавленных сред применяются значительно большие плотности тока, чем в электрогидрометаллургии, так как электропроводность расплавов значительно больше электропроводности водных растворов. Повышение плотности тока увеличивает выход по току до определенного предела (20000 А/м2). При электролизе на твердом катоде выделяющийся металл получают либо в жидком виде, когда температура электролита выше температуры плавления металла (натрий, магний), либо в твердом виде (порошки или дендриты), например при получении тугоплавких металлов.
В электролите необходимо поддерживать высокую концентрацию соли выделяемого металла, иначе процесс будет нарушаться. Для предотвращения этого в электролит непрерывно добавляют соли осаждаемого металла.
Необходимо, чтобы выделяемый на катоде металл хорошо смачивал его и отлагался в виде компактного слоя. В противном случае получаемый металл выделяется в несплошном виде (в виде отдельных частиц), что увеличивает его соприкосновение с электролитом и растворимость в нем; при этом происходит уменьшение выхода по току.
Электролиз с жидким катодом используют в технике для получения товарных сплавов, например тройного сплава РЬ — Na — К, или для получения промежуточных сплавов, из которых затем вакуумной разгонкой получают нужный металл. В технике так получают металлический кальций и калий.
Процессы электролиза расплавленных сред происходят как с растворимыми, так и с нерастворимыми анодами. Растворимые аноды применяют в электрометаллургии при рафинировании и получении чистых металлов (например, рафинирование Al, Mg). Основные процессы электролиза расплавленных сред осуществляются с нерастворимыми угольными или графитовыми анодами.
Для каждого электролита существует анодная плотность тока (критическая), выше которой возникает анодный эффект, заключающийся в повышении напряжения и падении силы тока. Эта критическая плотность зависит от природы электролита, примесей в нем, температуры и материала анода. Наличие оксидов в ванне предотвращает анодный эффект.
Электролиз расплавленных сред по сравнению с гидроэлектрометаллургией характеризуется кроме указанных рядом других технологических и температурных особенностей. Одной из них является проведение процесса при повышенной температуре, которая поддерживается либо внешним подогревом, либо за счет джоулевой теплоты, вызываемой током электролиза, что чаще всего и осуществляется.
Для уменьшения тепловых потерь электролизера должна быть осуществлена хорошая тепловая изоляция, Вторая особенность — это выбор и применение для изготовления оборудования материалов, стойких в условиях электролиза расплавленных сред.
Электролитическое получение алюминия. Сочетание легкости и прочности, высокой коррозионной стойкости с отличной электро- и теплопроводностью сделало алюминий и сплавы на его основе важнейшими конструкционными материалами современности. Активное развитие получил электролитический способ производства алюминия во второй половине XIX в. Большое значение в разработке технологии его получения имели работы русских и советских ученых П. П. Федотьева, Ю. В. Баймакова и др.
Исходным сырьем для получения алюминия служат бокситы, нефелины, алуниты и каолины. Важнейшей рудой являются бокситы, содержащие от 30 до 60 — 70% А12О3. Бокситы измельчают и обрабатывают чаще всего в растворе щелочи, получая водорастворимый алюминат натрия NaAlO.2, отделимый от нерастворимого осадка (натриевый алюмосиликат), являющегося отходом производства. Разложением растворов алюмината натрия выделяют гидроксид алюминия, который при последующем прокаливании превращается в А12О3 (глинозем).
Получение алюминия сводится к электролизу расплава А12О3, температура плавления которого около 2093 °С. Снижение высокой температуры плавления оказалось возможным в результате применения криолита Na3AlF6, в котором растворяется А12О3 (до 10% по массе). При этом температура плавления снижается до 960 °С.
Процесс электролиза сводится к выделению на стальном катоде электролизера, футерованном угольными блоками, металлического алюминия и сгоранию угольного анода в результате выделения на нем кислорода. Схема электролизера с самообжигающимся анодом показана на рис. 6.1. Плотность алюминия больше плотности расплавленного электролита, в результате чего он скапливается на поддоне электролизера, откуда откачивается с помощью специальных вакуум-ковшей один раз в 1 — 2 сут. Электролиз ведут при температуре 950-960 °С^_ напряжении 4,2 — 4,5 В, с выходом по току 85-90%. На 1 т алюминия расходуется 1,92—1,94 т глинозема, 40 — 50 кг криолита, 20 — 25 кг фторида алюминия, 0,52 — 0,6 т анодной массы, расход электроэнергии составляет 14000-16000 кВт-ч.
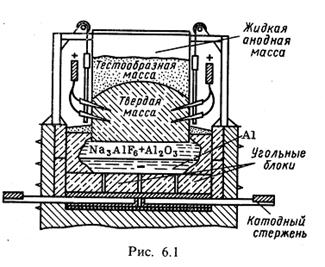
Эксплуатация электролизеров состоит из следующих технологических операций: введение глинозема, регулирование напряжения, извлечение алюминия, обслуживание самообжигающихся анодов или замена обожженных анодов. Анодные газы содержат оксиды углерода, фтористый водород, а также смолистые вещества и частицы глинозема и криолиты. Эти вещества загрязняют атмосферу, а при безотходном производстве их переработка дает ценные продукты промышленности.
Совершенствование электролизеров шло главным образом по линии увеличения амперной нагрузки при сохранении нормальных эксплуатационных характеристик. Если первоначально сила тока на один электролизер составляла 4000 — 5000 А, то в современных электролизерах она достигает 20000 А и выше. При этом снижается удельный расход энергии на 1 кг алюминия (с 42 до 14 кВт-ч). Получаемый при электролизе алюминий содержит различные примеси (водород, глинозем, фториды, углерод). Имеется ряд способов рафинирования: барботированием через расплавленный алюминий газообразного хлора, переплавкой металла в отражательных электрических печах. Для получения алюминия высокой чистоты (99,99%) металл подвергают дополнительному электролитическому рафинированию.
Дата добавления: 2016-06-22; просмотров: 3539;











