РОЛЬ КАТАЛИТИЧЕСКИХ ПРОЦЕССОВ, ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ И ОПРЕДЕЛЕНИЯ
Роль катализа в современной технологии трудно переоценить. Катализ — это изменение скорости химических реакций под влиянием особых веществ — катализаторов. Катализатор, помогая осуществить химическую реакцию, по окончании ее выделяется в неизменном виде; таким образом, роль катализатора сводится к изменению пути протекания химических реакций.
В настоящее время в химической промышленности и смежных с нею отраслях свыше 90% вновь вводимых технологий составляют каталитические процессы. На основе катализа производятся десятки тысяч наименований промышленной продукции (неорганические кислоты, аммиак, мономеры для синтеза полимеров, различные органические кислоты, спирты, альдегиды и др.). Катализ широко применяется в производстве лекарственных веществ, моющих средств, является основой новых процессов нефтехимического синтеза, реакций получения полимеров.
На основе катализа созданы перспективные способы производства моторных топлив из угля, сланцев и торфа; широкое применение находят каталитические процессы гидрирования жиров в пищевой промышленности.
Все больше используется катализ для охраны окружающей среды от загрязнений . сточными водами, вредными промышленными автомобильными газами.
Отличаясь высокими технико-экономическими показателями, будучи в большинстве своем непрерывными, замкнутыми, безотходными, малоэнергоемкими процессами с высоким выходом промышленной продукции, каталитические процессы практически не имеют ограничений в областях применения и по сумме технологических и экономических показателей не имеют себе равных.
Первое представление явления катализа было дано в 1835 г. одновременно Берцелиусом и Митчерлихом, которые определили катализ как возбуждение химической реакции в присутствии веществ, которые не потребляются в реакции. Это было начало науки о катализе, хотя не было ответа на вопрос о том, в чем сущность катализа и какие реакции могут быть каталитическими. Следующий шаг в развитии катализа сделал Оствальд, который дал определение катализатору-веществу: катализатором является всякое вещество, которое, не входя в конечные продукты химической реакции, изменяет ее скорость. Это определило границы возможности катализа, но не раскрыло причину и природу каталитического действия. Потребовались десятилетия, чтобы представление о химической природе катализа получило всеобщее признание.
Большую роль в области создания современной теории катализа сыграли работы советских ученых: А. А. Баландина, Н. Н. Семенова, Г. К. Борескова и др.
Каталитические процессы подчиняются общим законам химии и термодинамики, но имеют ряд особенностей и преимуществ: катализ позволяет интенсифицировать химические превращения, включая и реакции, которые без катализатора практически не протекают, катализаторы дают возможность направлять химическую реакцию в сторону образования желаемого продукта, в реакциях синтеза высокополимеров позволяют регулировать строение и свойства конечных материалов.
Катализ — явление специфичное; для каждой реакции используется свой катализатор. В качестве катализаторов используются различные вещества: газы, жидкости, твердые тела.
Теория катализа и виды его» Каталитические процессы принято формально делить на три вида: гомогенный, гетерогенный и микрогетерогенный. Четких границ между этими видами нет. Сущность этих процессов одинакова и основана на образовании промежуточных соединений реагента с катализатором.
В гомогенном катализе катализатор и реагирующие вещества образуют одну общую фазу, чаще всего газ или жидкость. При гетерогенном катализе катализатор и реагенты образуют разные фазы и каталитическая реакция осуществляется на границе их раздела. Обычно катализатор — твердый, а реагирующие вещества — газ или жидкость.
Микрогетерогенный катализ происходит в жидкой фазе с участием коллоидных частиц в качестве катализаторов. Ферментативный катализ, происходящий в растительных и животных клетках, осуществляется под действием биологических катализаторов белковой природы — ферментов. Ферментативным реакциям обычно свойственна очень высокая селективность.
Различают положительный и отрицательный катализ. Положительный катализ, или просто катализ, — это когда в присутствии катализатора реакции ускоряются, отрицательный катализ — когда в присутствии антикатализаторов (ингибиторов) процессы замедляются.
Теория каталитических процессов — сложная и недостаточно изученная область современной физической химии. Существует несколько различных теорий, объясняющих механизм действия катализаторов, из которых наиболее распространенной является теория промежуточных соединений.
Ускоряющее действие катализатора отличается от влияния таких факторов, как температура, давление и др. Например, изменение давления ускоряет реакцию, смещая равновесие, а повышение температуры приводит к увеличению энергетического уровня реагирующих молекул, к увеличению скорости процесса. В присутствии катализатора энергетический уровень реагирующих молекул не меняется, равновесие не смещается. Катализатор снижает энергию активации химической реакции благодаря изменению реакционного пути. При этом катализатор взаимодействует с реагирующими веществами и входит в состав промежуточного активного комплекса. При действии катализатора процесс протекает через ряд промежуточных стадий, для осуществления которых в сумме требуется меньше энергии активации, чем на процесс без катализатора.
По механизму взаимодействия катализатора с реагентами все гомогенные и гетерогенные каталитические реакции делят на два класса: окислительно-восстановительное и кислотно-основное взаимодействие. Механизм окислительно-восстановительного (электронного) катализа основан на обмене электронами между катализатором и реагентами. Механизм кислотно-основного (ионного) катализа заключается в обмене атомами между катализатором и реагирующими молекулами. Для окислительно-восстановительных реакций наиболее распространенные катализаторы — это переходные металлы или оксиды и сульфиды металлов (полупроводники). Для кислотно-основных каталитических процессов наиболее типичные катализаторы — это кислоты, основания или твердые инертные вещества, пропитанные кислотами или основаниями, и др.
Гомогенный катализ. Механизм гомогенного катализа основан на образовании промежуточных нестойких химических соединений между катализатором и реагентами. Гомогенные каталитические процессы делятся по фазовому состоянию на жидкофазные и газофазные, а по типу промежуточных соединений (реагент-катализатор) - на процессы с кислотно-основным и окислительно-восстановительным механизмом.
При кислотно-основном катализе в растворе происходит обмен протонами между катализатором и реагентами. Основными катализаторами для процессов в растворе являются кислоты, основания, ионы металлов и др.
Примером гомогенного кислотно-основного катализа в растворе являются процессы гидратации, дегидратации, гидролиза, поликонденсации и др., например гидратация этилена в присутствии катализатора (серной кислоты) с образованием этилового спирта
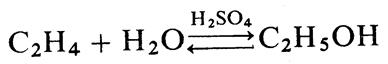
Газофазный гомогенный катализ используется довольно редко.
При окислительно-восстановительном механизме происходит обмен атомами между реагентом и катализатором. Например, процесс окисления диоксида серы оксидами азота при башенном способе производства серной кислоты происходит по молекулярному механизму:
NO + ½О2 = NO2, NO2 + SO2 = SO3 + NO
На скорость гомогенного каталитического процесса влияет ряд факторов: концентрация катализатора и реагентов, температура, давление, интенсивность перемешивания. Температура, давление, перемешивание оказывают влияние на скорость процесса согласно общим законам кинетики. Влияние концентрации реагентов и катализатора на скорость процесса зависит от лимитирующей стадии каталитического процесса.
Гомогенный катализ имеет ряд преимуществ: высокую скорость процесса; легкость управления процессом; возможность применения простого оборудования.
К недостаткам гомогенного катализа следует отнести: сложность выделения катализатора из конечного продукта; потерю катализатора; загрязнение получаемого продукта.
Эти недостатки отсутствуют в гетерогенном катализе.
Гетерогенный катализ в промышленности используется чаще. Катализатор в основном твердый, а реагент — в виде газа или жидкости. Промышленные твердые катализаторы называют контактами, поэтому гетерогенный катализ называют контактным.
Механизм гетерогенного катализа может быть ионным или электронным. При электронном катализе в качестве катализаторов используются главным образом серебро, медь, молибден, вольфрам, железо, платина и другие или их оксиды. Механизм электронного гетерогенного катализа основан на процессе адсорбции (хемосорбции) реагентов поверхностью катализатора.
Механизм ионного гетерогенного катализа, как и гомогенного, основан на обмене ионами между реагентами и катализатором. Для ионного катализа в качестве катализаторов используются твердые кислоты и основания. Кислотными катализаторами могут быть малолетучие кислоты — фосфорная и серная, нанесенные на пористые носители, или кислые соли этих кислот, а также алюмосиликаты, оксиды кремния, алюминия и др.
Основными катализаторами являются окиси и гидроксиды щелочных и щелочноземельных металлов и др. К кислотно-основному гетерогенному катализу относятся реакции гидратации, дегидратации, изомеризации и др. Процесс гетерогенного катализа на твердых катализаторах состоит из нескольких стадий: диффузии реагентов к поверхности зерен катализатора; адсорбции (хемосорбции) реагентов на поверхности катализатора с образованием непрочных комплексов, реагент-катализатор; перегруппировки атомов с образованием новых комплексов, продукт-катализатор; десорбция (отрыв) готового продукта с поверхности катализатора; диффузии готового продукта от поверхности катализатора во внешнюю среду.
Кинетика гетерогенных каталитических процессов. Скорость гетерогенного каталитического процесса является суммой скоростей отдельных его стадий. Скорость каждой стадии зависит от многих факторов: температуры, давления, концентрации, времени контактирования, перемешивания смеси. Если, например, лимитирующими стадиями процесса катализа являются кинетические (температура, давление, концентрация), то тогда температура является главным фактором увеличения скорости катализа. Если же лимитирующими стадиями являются диффузионные (время контакта, перемешивание), то для увеличения скорости процесса необходимо изменять фактор перемешивания фаз. Концентрация реагентов и давление оказывают влияние на все стадии катализа.
Наибольшее значение для оптимального протекания каталитических процессов имеет температура. Температурный режим устанавливается таким, чтобы он способствовал более полному использованию сырья при оптимальной скорости его переработки. В зависимости от знака теплового эффекта каталитических реакций [эн-до-(плюс) или экзотермических (минус)] повышение температуры неодинаково влияет на выход продукта.
Для обратимых эндотермических реакций выход продукта непрерывно растет с повышением температуры. Например, конверсия метана на Ni-катализаторе является эндотермическим процессом:
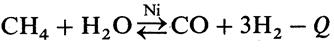
На рис. 7.1 представлена зависимость степени конверсии метана от температуры — эндотермический процесс (кривые 1,2 — равновесный выход, 3 — фактический выход). Из рисунка видно, что конверсия метана растет с увеличением температуры.
Равновесный выход продукта для обратимых экзотермических реакций (рис. 7.2) уменьшается с ростом температуры, а фактический выход имеет максимум при оптимальной температуре (τх > τ2 > τ3, где τ - время контактирования).
Положение оптимальной кривой зависит от активности катализатора, концентрации реагирующих веществ. Примером каталитических экзотермических реакций может быть процесс синтеза аммиака
ЗН2 4- N2 = 2NH3 + Q
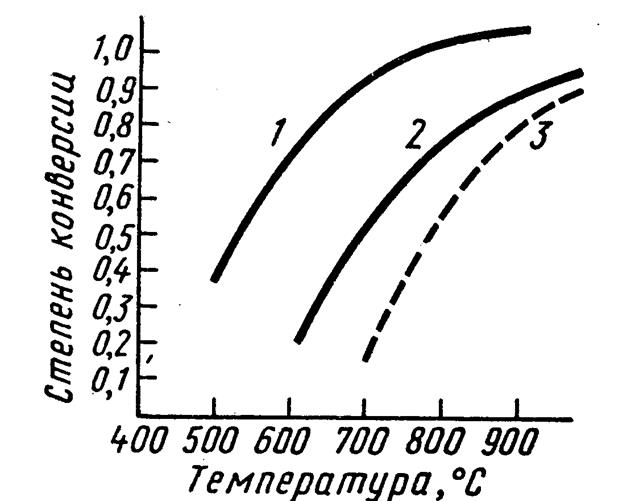
Рис. 7.1
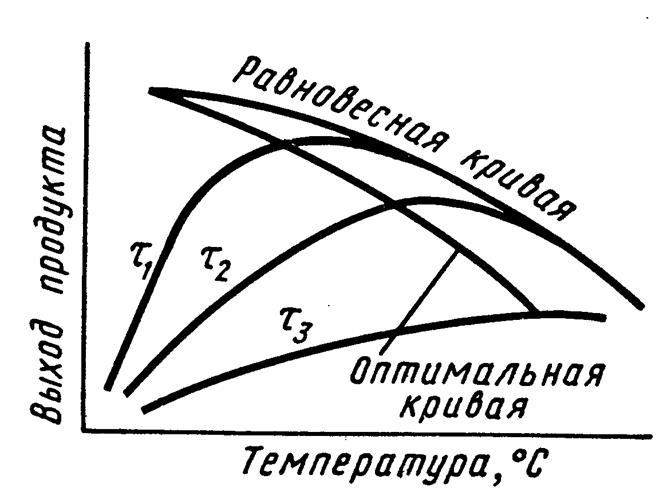
Рис. 7.2
а также окисление диоксида серы, конверсия оксида углерода и др. При проведении подобных процессов необходимо быстро отводить большое количество теплоты, так как избыток ее может привести к спеканию катализатора, диссоциации реагентов и образованию взрывоопасных реакций.
Фактор давления используется для увеличения выхода продукта. Для обратимых каталитических процессов, идущих с уменьшением объема (например, аммиака, метанола и др.), выход продукта увеличивается при повышении давления. Для повышения выхода продуктов в процессах, протекающих с увеличением объема, необходимо давление уменьшать (например, процессы дегидрирования, дегидратации и др.).
Концентрацию реагентов необходимо увеличивать для повышения выхода продукта каталитических процессов. Для экзотермических процессов увеличение концентрации реагентов требует быстрого отвода теплоты во избежание взрывоопасности и падения активности катализатора.
Время контактирования на каталитический процесс оказывает сильное влияние: с увеличением времени контактирования выход продукта растет, а производительность катализатора падает. Время контактирования для проведения реакций тем будет больше, чем меньше активность катализатора.
Перемешивание реагентов с катализатором проводят для снятия внешнедиффузионных сопротивлений, выравнивания температуры.
Влияние всех факторов на каталитический процесс практически не отличается от их влияния на некаталитический. Особым фактором для оптимального ведения каталитических процессов является чистота реагентов.
Состав, характеристика и свойства твердых катализаторов. Твердые катализаторы в промышленности чаще всего выпускаются в виде зерен, таблеток, гранул. Твердые катализаторы называют контактами, которые представляют смесь нескольких компонентов: собственно катализатор, активатор и носитель.
Катализаторы — это, в основном, металлы и их оксиды, например медь, серебро, платина, хром, молибден, железо, кобальт и др. Часто металлы применяются в дисперсной форме на поверхности носителей.
Активаторы, или промотеры,- это вещества, которые сами не влияют на данную реакцию, но сильно ускоряют ее. Они повышает активность основного катализатора, увеличивают продолжительность его работы за счет образования новых активных центров в местах соприкосновения. Активаторы добавляются к основному катализатору в очень небольших количествах.
Влияние их специфично для каждого катализатора. Например, для Pt-катализатора в качестве промоторов используются железо, алюминий и диоксид серы.
Носители, или трегеры, представляют собой пористые индифферентные вещества, на которые наносят металл-катализатор. В качестве носителей применяется пемза, силикагель, каолин, активированный уголь, алюмосиликаты и др. Носители увеличивают поверхность катализатора и тем самым повышают его активность. Кроме того, носители предохраняют от спекания активную поверхность катализатора и увеличивают прочность контактов. С экономической точки зрения носители снижают себестоимость катализатора.
Качество промышленных твердых катализаторов оценивается некоторыми технологическими характеристиками: активностью, производительностью, температурой зажигания, селективностью и др.
Активность катализатора показывает, насколько снижает катализатор энергию активации реакций образования промежуточных комплексов и увеличивает скорость каталитического процесса. Каталитическая активность зависит в основном от химического состава и структуры катализатора.
Высокая активность катализатора повышает выход и качество продукта, снижает расход сырья, энергии, т. е. улучшает технико-экономические показатели процесса.
Производительность катализатора характеризует съем продукта с единицы объема катализатора.
Температура зажигания — это минимальная температура начала работы катализатора: чем активнее катализатор, тем ниже температура зажигания. Например, для Cr-катализатора температура зажигания ~200°С, а для V2О5-катализатора температура зажигания ~450°С
Селективность (избирательность) катализатора — это способность из множества одновременно протекающих реакций выбирать одну определенную реакцию. Селективность определяется отношением скорости образования требуемого продукта к общей скорости реакции.
Например, реакция окисления аммиака может протекать до различной стадии окисления:
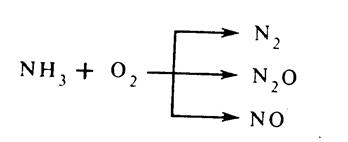
В присутствии Pt-катализатора процесс идет только до окисления в NO
HNO3 + 5О2 à 4NO + 6Н2О + Q
Скорость этой реакции велика по сравнению с другими стадиями окисления и проходит за доли секунды. Очень большой селективностью отличаются катализаторы-ферменты.
Механическая прочность твердого катализатора зависит от пористости структуры. Увеличение пористости, и в первую очередь крупных пор, уменьшает прочность твердого катализатора. Это особенно важно учитывать при выборе оптимальной структуры катализатора, при которой степень использования внутренней поверхности зерен максимальна.
Под действием контактных ядов происходит отравление катализатора — частичная или полная потеря каталитической активности. Ядами являются примеси исходных веществ или продукты реакции. При отравлении катализатора образуется химическое соединение: яд -f + катализатор или происходит адсорбция яда на поверхности катализатора.
Различают обратимое и необратимое отравление катализатора. Обратимое отравление приводит к временной потере активности катализатора. При удалении отравленного катализатора из зоны реакции и разрушении комплекса (яд + катализатор) активность катализатора восстанавливается. При необратимом отравлении катализатора активность не восстанавливается даже при удалении контактных ядов. Яд удаляют выжиганием или химическим путем.
Каталитические яды специфичны для каждого катализатора. Например, для Pt-катализатора ядами являются сероводород, синильная кислота, соединения мышьяка, ионы металлов Pb2+, Sn2+, Cu2+, Fe2+ и др.
Активность катализатора сильно падает от механической пыли газовых реагентов. Поэтому их предварительно очищают от пыли. Используется сухой и мокрый методы очистки. Очистку ведут в электрофильтрах, где
|
пыль осаждается под действием электростатического поля, или в циклонах — под действием центробежной силы. При мокрой очистке газовые реагенты промывают водой под давлением.
Аппаратура для каталитических процессов. Для гомогенного и гетерогенного катализа используются различные аппараты. Для гомогенных каталитических процессов — башни, камеры, колонны и т. д. Например, гомогенное окисление SO2 оксидами азота при нитрозном способе производства серной кислоты проводится в башнях с насадкой. Для гетерогенного катализа используются так называемые контактные аппараты различной конструкции. Контактные аппараты классифицируются по агрегатному состоянию реагентов и катализатора, по способу контакта катализатора с реагентами и по способу отвода теплоты.
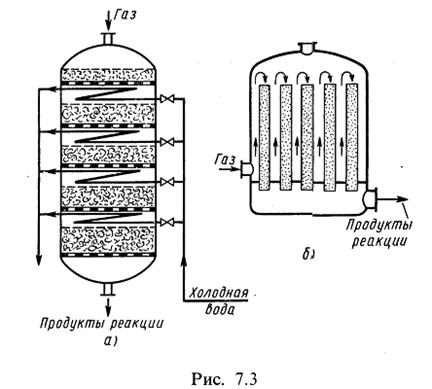
В зависимости от агрегатного состояния катализатора контактные аппараты делят на три группы: с неподвижным слоем катализатора, с псевдосжиженным слоем катализатора и с движущимся слоем катализатора. В промышленности в большинстве случаев используются контактные аппараты с неподвижным слоем катализатора (рис. 7.3, а, б). По расположению катализатора в аппарате они делятся на полочные (рис. 7.3, а), в которых катализатор располагается на полках, и трубчатые (рис. 7.3,6), в которых катализатор находится в трубах. Контактные полочные аппараты делятся по количеству слоев катализатора на аппараты с одним или несколькими слоями и по способу отвода теплоты, когда охлаждающие элементы располагаются внутри или вне аппарата. Наиболее распространенный полочный контактный аппарат представлен на рис. 7.3, а. В этом аппарате теплообменники расположены между дырчатыми полками с катализатором. Высота слоя катализатора увеличивается по ходу газа, а высота теплообменников уменьшается, так как с уменьшением скорости реакции уменьшается и количество теплоты, выделяющейся при реакции. Теплообмен в таких аппаратах осуществляется по принципу противотока.
В контактных полочных аппаратах с охлаждением смеси вне аппарата газовая смесь поступает в реактор сверху, последовательно проходит через слои катализатора и после каждой стадии контактирования направляется в теплообменники. Недостаток полочных контактных аппаратов в том, что отвод теплоты происходит ступенчато и поэтому каталитическая реакция и теплообмен происходят одновременно.
Трубчатые контактные аппараты с катализаторами в трубах представлены на рис. 7.3, б. В случае эндотермических процессов катализаторные трубы омываются горячими поточными газами в межтрубном пространстве. Газовая смесь и теплоноситель поступают по принципу противотока. Теплообмен в трубчатых контактных аппаратах непрерывный и происходит одновременно с реакцией. Такие аппараты применяются, например, для дегидрирования бутана, каталитической конверсии метана.
При экзотермических процессах катализатор в трубах омывается холодным газом. Трубы с катализатором, открытые сверху, омываются газом, поступающим снизу вверх. Далее газ проходит через слой катализатора сверху вниз, а хладагент — снизу вверх по принципу противотока. Теплота в таких аппаратах отводится непрерывно в течение процесса. Недостатки трубчатых аппаратов: температурный режим далек от оптимального, недостаточен отвод теплоты от катализатора, громоздкость теплообменных устройств.
Часто применяются контактные аппараты с двойными теплообменными трубами, помещенными в катализатор. Газ проходит вначале по внутренней трубе, а затем по кольцевому пространству между трубами, нагреваясь до температуры зажигания. Нагретый газ поступает в слой катализатора. Температурный режим в этих аппаратах ближе к оптимальному, чем в простых трубчатых. Примером такого контактного аппарата является колонна синтеза аммиака при среднем давлении. Иногда применяют комбинированные контактные аппараты с неподвижным слоем катализатора, например трубчато-полочные с катализатором и на полках и в трубах. В них достигается лучший оптимальный режим.
Контактные аппараты с неподвижным слоем катализатора имеют ряд недостатков: не осуществляется интенсивный отвод теплоты от катализатора; наблюдается значительное отклонение от оптимального температурного режима;
производительность катализатора низкая, так как внутренняя поверхность части катализатора не используется;
не используется мелкозернистый катализатор, так как частицы слеживаются во время работы и снижается каталитическая активность его; замена катализатора происходит не непрерывно, а периодически.
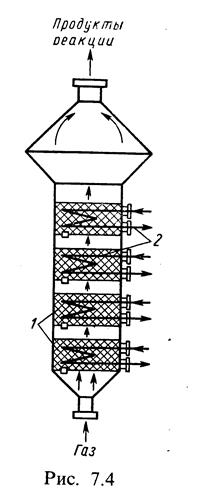
В последнее время в промышленности начали успешно использовать контактные аппараты с псевдосжиженным — кипящим (рис. 7.4) и с движущимся слоем катализатора.
В контактных аппаратах с псевдосжиженным катализатором слой катализатора напоминает кипящую жидкость. Газ проходит снизу вверх через решетки 2 с катализатором с такой скоростью, которая приводит частицы катализатора 1 во взвешенное состояние. Реакторы с псевдосжиженным слоем могут быть и однослойными и многослойными. В многослойном контактном аппарате температурный режим близок к оптимальному. В контактном аппарате такого типа для экзотермических реакций газовая смесь проходит снизу вверх через газораспределительные решетки, на которых и образуется взвешенный слой катализатора. Продукты реакции удаляются сверху. Внутри слоев катализатора расположены водяные холодильники для отвода теплоты от катализатора.
Аппараты с кипящим взвешенным слоем применяются для проведения каталитических процессов, в которых обязательна непрерывная смена катализатора: дегидрирование углеводородов, каталитический крекинг и др.
В контактном аппарате с движущимся слоем катализатора газ поступает снизу, а вверху падают частицы катализатора. Катализатор снизу выводится из аппарата и поступает снова после регенерации сверху в аппарат. Температурный режим близок к оптимальному. Реакторы с движущимся слоем катализатора используются для каталитических процессов, в которых необходимо непрерывное перемещение катализатора, например процесс крекинга нефтепродуктов в паровой фазе.
Реакторы с кипящим слоем катализатора имеют и преимущества и недостатки по сравнению с реакторами с неподвижным слоем. Преимущества: размер частиц катализатора меньше и более полно используется внутренняя поверхность их; температурный режим близок к оптимальному; производительность катализатора более высокая; замена катализатора осуществляется непрерывно. Недостатки: происходит истирание зерен катализатора (~10% в год); получаемые продукты загрязняются пылью от катализатора; необходимо использовать особо прочные катализаторы; создается большое гидравлическое сопротивление.
Дата добавления: 2016-06-22; просмотров: 6697;











