СТЕХИОМЕТРИЧЕСКИЕ ЗАКОНЫ ХИМИИ.
Стехиометрией называется раздел химической науки, который изучает количественные отношения между веществами в химических процессах. Стехиометрия лежит в основе химического анализа и является фундаментом в развитии теоретической химии.
Основные стехиометрические законы:
1. Закон сохранения материи.
Масса веществ, вступающих в химическую реакцию равна массе веществ, образующихся в результате ее.Закон был высказан в 1748 г. и обоснован в 1756г. русским ученым М.В. Ломоносовым.
С точки зрения атомно-молекулярного учения смысл закона сохранения массы веществ заключается в том, что атомы имеют постоянную массу, а их общее количество в ходе реакции не изменяется, поэтому масса веществ до и после реакции остается постоянной. Например:
а) 2Mg + O2 → 2MgO б) (NH4)2 Cr2 O7 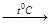 N2 + Cr2O3 + 4H2O
N2 + Cr2O3 + 4H2O
2∙24 + 16∙2 → 2(24+16)28 + 152 + 72
80 → 80 252 ® 252
На основании закона сохранения массы можно составлять химические уравнения и по ним производить необходимые расчеты.
Задача.Сколько выделится Pb, если при погружении в раствор Pb(NO3)2 цинковой  пластинки ее масса увеличилась на 7,1 г?
пластинки ее масса увеличилась на 7,1 г?
Для решения задачи необходимо записать уравнение реакции:
Pb(NO3)2 + Zn → Zn(NO3)2 + Pb ,
65 207
где 65 – молярная масса цинка; 207 – молярная масса свинца. По уравнению реакции, при увеличении массы цинковой пластинки на 142 грамма (207-65)- свинца выделится 207г, а при увеличении массы цинковой пластинки на 7,1 г – свинца выделится X г. Найдем массу свинца.
X=(mPb)= 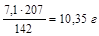 .
.
2. Закон постоянства состава.
Всякое чистое вещество независимо от способа его получения всегда имеет постоянный количественный и качественный состав.Закон был сформулирован французским ученым Ж.Л.Прустом в 1808 году.
Например, молекула воды имеет постоянный количественный (на два атома водорода приходится один атом кислорода) и качественный состав (Н; О), не зависимо от способов получения:
CuO + H2 ® H2O + Cu
CH4 + 2O2 ® 2H2O + CO2
C2H5OH + 3O2 ® 3H2O + 2CO2
H2SO4 + 2NaOH ® 2H2O + Na2SO4
Чистота веществ определяется по t0C плавления, t0Скипения, плотности, спектрам.
3.Закон Авогадро.
Дата добавления: 2020-04-12; просмотров: 653;











