Рассмотрим примеры решения задач.
Задача 1. Вычислите молярную массу эквивалента металла в оксиде, содержащем 52% металла. Назовите этот металл, если он шестивалентен в данном оксиде. Составьте формулу оксида.
Решение: 100 – 52 = 48% кислорода в оксиде.
По закону эквивалентных отношений записываем выражение:
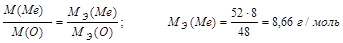
m (Me) = MЭ (Ме)∙В = 8,66∙6 = 52 г/моль
Шестивалентным металлом с атомной массой 52 а.е.м. является хром. Его оксид CrO3.
Задача 2. На восстановление 7,09 г оксида металла требуется 2,24 л водорода (н.у.). Вычислите молярную массу эквивалента металла и его оксида.
Решение.
На основании закона эквивалентных отношений записываем выражение:

MЭ (Ме xОy) = MЭ (Ме) +MЭ (О); (МЭ (О)=8 г/моль), тогда
MЭ (Ме) = 35,45 – 8 = 27,45 г/моль.
Задача 3. Из 3,85 г нитрата металла Me(NO3)x получено 1,60 г его гидроксида Me(OH)x. Вычислите эквивалентную массу металла.
Решение.
На основании закона эквивалентных отношений записываем выражение:
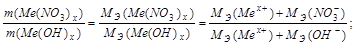

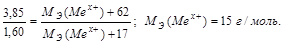
Задача 4. При взаимодействии 3,24 г трехвалентного металла с кислотой выделяется 4,03 л Н2 (н.у.). Вычислите молярную массу эквивалента и молярную массу металла. Назовите металл.
Решение.
Используя закон эквивалентных отношений, запишем выражение:
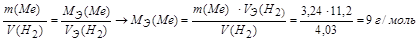
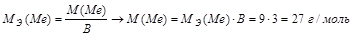
Металл – алюминий.
Знание закона эквивалентных отношений необходимо для:
1. химических расчетов и идентификации веществ.
2. определения молярной концентрации эквивалентов вещества в растворе и использование полученных расчетов в объемном анализе.
Дата добавления: 2020-04-12; просмотров: 807;











