Нахождение молярной массы эквивалентов сложных веществ по уравнениям химических реакций.
Для кислот:
а) H3PO4 + 2NaOH = Na2HPO4 + 2H2O;
б) H3PO4 + 3NaOH = Na3PO4 + 3H2O.
В реакции «а» заместилось два иона водорода кислоты,
а в реакции «б» – три. Следовательно, основность кислоты в первом случае равна двум, а во втором случае – трем:
а) МЭ (Н3РО4) = 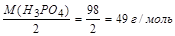 ;
;
б) МЭ (Н3РО4) = 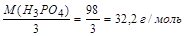 .
.
Для оснований:
а) А1 (ОН)3 + НС1 → А1(ОН)2С1 + Н2О, кислотность основания
равна 1;
б) А1(ОН)3 + 2НС1 → А1ОНС12 + 2Н2О, кислотность основания
равна 2
а) МЭ (А1(ОН)3) = 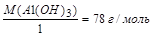
б) МЭ (А1(ОН)3) = 78/2 = 39 г/моль.
Нахождение молярной массы эквивалентов веществ по уравнениям окислительно-восстановительных реакций:
2KMnO4 + 5SnCl2 + 16HCl = 5SnCl4 + 2MnCl2 + 2KCl + 8H2O

 восстановитель Sn+2 - 2ē → Sn+4 5 окисляется
восстановитель Sn+2 - 2ē → Sn+4 5 окисляется
окислитель Mn+7 + 5ē → Mn+2 2 восстанавливается
Молярная масса эквивалента окислителя равна отношению молярной массы окислителя (M(KMnO4)) к количеству принятых электронов.
МЭ(KMnO4) = 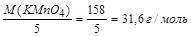 .
.
Молярная масса эквивалента восстановителя равна отношению молярной массы восстановителя (M(SnCl2)) к количеству отданных электронов.
МЭ (SnCl2) = 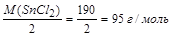 .
.
4. Закон эквивалентных отношений: массы реагирующих веществ: m(A) и m(B) относятся между собой как молярные массы их эквивалентов: МЭ (А) и МЭ (В).
Математические выражения этого закона:
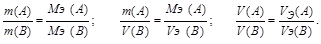
Дата добавления: 2020-04-12; просмотров: 712;











