Повышение температуры кипения идеального раствора
Кипение жидкости наступает тогда, когда давление насыщенного пара над раствором равно внешнему давлению. Зависимость давления насыщенного пара от температуры определяется уравнением Клаузиуса-Клапейрона 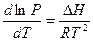 , см. рис. 3
, см. рис. 3
Рисунок 3 - Давление пара в зависимости от температуры: 1 - для чистого растворителя; 2,3 - для растворов, Сз>С2; 4 - для твердого чистого растворителя.
Давление насыщенного пара чистого растворителя равно внешнему при 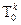 , давление паров над растворами при этой температуре меньше внешнего и потому кипения растворов не будет. Внешнее давление достигается при более высоких температурах
, давление паров над растворами при этой температуре меньше внешнего и потому кипения растворов не будет. Внешнее давление достигается при более высоких температурах 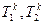 . Величина повышения температуры кипения:
. Величина повышения температуры кипения: 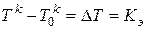 в,
в,
где Кэ - эбулиоскопическая постоянная, определяемая свойствами растворителя, величина, равная повышению температуры кипения одномоляльного раствора неэлектролита. 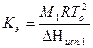
где М1- молярная масса растворителя, кг/моль; 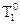 - температура кипения чистого растворителя при Р = 1 атм, К; DНисп.- молярная теплота испарения растворителя, Дж/моль.
- температура кипения чистого растворителя при Р = 1 атм, К; DНисп.- молярная теплота испарения растворителя, Дж/моль.
Таким образом, величина DT не зависит от природы растворенного вещества, а лишь от его концентрации и природы растворителя. (Это относится к растворам неэлектролитов; в случае электролитных растворов за счет диссоциации число частиц растворенного вещества увеличивается, DР и DT увеличиваются).
Дата добавления: 2016-06-22; просмотров: 1921;











